
생화학분자생물학회입니다.
PI3K/AKT 활성화에 의해 유도되는 PTEN 단백질 유비퀴틴화 및 분해 기전과 암 발생에서의 중요성 연구
작성자
관리자작성일자
2016-01-01조회수
725 |
|
이민식 연세대학교 생명시스템대학 생화학과
|
송재환 연세대학교 생명시스템대학 생화학과 |
연구배경
세포 성장 및 암 발생에 기여하는 PI3K/AKT 신호전달은 다양한 암 종에서 활성화 되어 있어, 암 치료의 주요한 표적 신호기전으로 연구되고 있다 (1). PI3K/AKT 신호전달의 길항물질인 PTEN(Phosphatase and Tensin Homologue)은 Phosphatidylinositol-3,4,5-Trisphosphate(PIP3)를 Phosphatidylinositol-4,5-Bisphosphate(PIP2)로 탈인산화시켜 PI3K/AKT의 활성화를 저해하는 역할을 하고, 결과적으로 PI3K/AKT 신호전달을 통한 암 발생 및 성장에 주요한 억제 단백질로 작용한다 (2, 3). 암 억제 단백질로서 PTEN의 중요성은 Cowden Syndrome, Bannayan–Zonana Syndrome, Lhermitte–Duclos Disease 같은 유전성 암 질환에서의 돌연변이, 다양한 암 환자 조직에서의 억제, Knock-Out 쥐에서 발생되는 암 등의 다양한 연구를 통해 증명되었다 (1-4). 대부분의 암 억제 단백질과 같이 PTEN의 단백질 수준 억제는 Human Cancer에서 빈번하게 관찰되지만 이 중 25% 정도만 유전적인 PTEN의 Mutation으로 확인되면서, PTEN의 단백질 수준에서의 조절(Posttranslational Modifications, PTMs)이 활발하게 연구되고 있다 (4-6). 특히, PTEN의 PTMs 중 단백질 안정도(Stability)를 조절할 수 있는 유비퀴틴화에 관한 연구가 암에서 빈번하게 관찰되는 PTEN의 단백질 수준 억제를 설명해 줄 수 있을 것으로 생각되고 있다.
유비퀴틴화(Ubiquitination)는 유비퀴틴 결합효소(E3-Liagse)와 유비퀴틴 탈착효소(deubiquitinase)에 의해 조절되며 유비퀴틴화 된 단백질은 프로테아좀(Proteasome)에 인식되어 분해되고, 이러한 과정을 통해 유비퀴틴화를 통한 단백질 수준 조절이 이루어 진다. PTEN 역시 유비퀴틴화를 통한 조절이 이루어지는 것이 연구되어 있고, 몇 가지 유비퀴틴 결합효소 및 유비퀴틴 탈착효소(NEDD4-1, WWP2, XIAP, CHIP, SPOP, USP7 (HAUSP), USP13)가 PTEN의 단백질 수준을 조절하는 것으로 보고되었다 (6-10).
PTEN의 유비퀴틴화를 통한 단백질 수준 조절이 몇 가지 암에서 관찰되고 있지만, ‘PTEN의 유비퀴틴화를 조절하는 유비퀴틴 결합효소 및 유비퀴틴 탈착효소가 조절되는 기전’과 ‘암이 발생하는데 유비퀴틴화를 통한 PTEN 단백질 수준의 조절이 어떻게 이루어지고 있는지’에 관한 연구가 필요한 상황이다. 이에 본 연구진은 PTEN을 조절하는 새로운 유비퀴틴 결합효소 MKRN1을 찾고 발암신호전달에 따른 MKRN1 및 PTEN 단백질이 조절기전에 대해서 연구하게 되었다.
연구결과
1. MKRN1에 의한 PI3K/AKT 신호 조절
암유전자(Oncogene)로 연구되고 있는 MKRN1이 암세포의 다양한 신호전달 중 어떤 신호전달에 관여하는지 Human Phospho-Kinase Array를 통해 확인한 결과 MKRN1이 억제된 암세포 주에서 발암신호전달 중 AKT 신호가 강하게 저해됨을 관찰하였다 (그림 1A). 이러한 결과는 MKRN1이 Knockout된 Mouse Embryonic Fibroblasts(MEFs)에서도 동일하게 관찰되었으며, 이때 PI3K/AKT 신호의 억제 단백질인 PTEN이 증가하는 것을 관찰하였다 (그림1 B, C). 이를 통해 MKRN1의 억제 시 활성화된 PTEN을 통하여 PI3K/AKT 신호 억제를 유도할 수 있다는 가설을 세울 수 있었고, 암세포 주에서 PTEN이 억제된 환경에선 MKRN1이 PI3K/AKT 신호를 더 이상 조절할 수 없음을 확인함으로써 이를 증명하였다 (그림 1D).
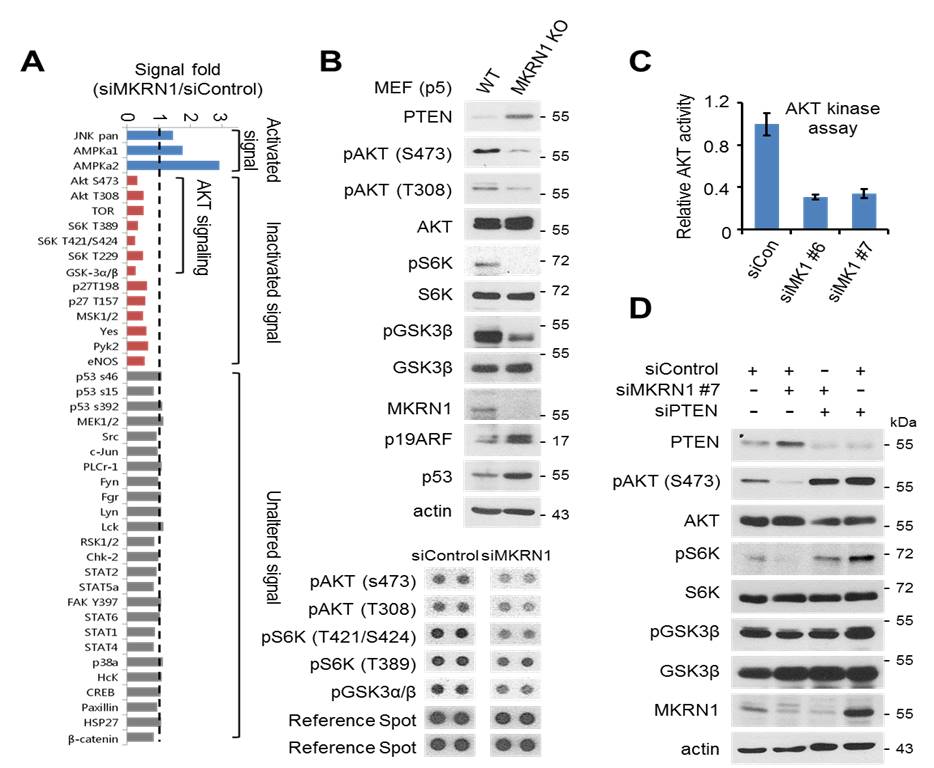
그림 1. MKRN1의 억제는 PTEN을 통해 PI3K/AKT 신호를 저해함
암세포 주에 siRNA의해 MKRN1이 억제(Knockdown) 되거나 Knockout 되면, 다양한 신호 전달 중 PI3K/AKT 발암신호기작(pAKT, pS6K, pGSK3β)이 특이적으로 저해됨을 관찰하였다 (A-C). 또한 MKRN1의 억제가 PTEN의 단백질을 증가시키고 이를 통해 PI3K/AKT 신호를 저해하는 것으로 관찰하였다 (D).
2. Human 자궁경부암에서 AKT/MKRN1/PTEN의 유의성
앞선 AKT/MKRN1/PTEN의 분자적 조절 확인을 기반으로 pAKT와 MKRN1, PTEN의 발현양상이 자궁경부암에서 유의성을 보이는지 확인하였다. 조직면역법을 사용하여 각 병기(Stage)별 자궁경부암 환자 조직에서 pAKT와 MKRN1, PTEN의 단백질 수준을 정량한 결과, 병기(Stage)가 올라갈수록 pAKT와 MKRN1이 유의성 있게 증가하고 PTEN의 경우 유의성 있게 감소하는 것을 확인하였다 (그림 2A). 이러한 pAKT와 MKRN1의 양의 관계와 MKRN1과 PTEN의 음의 관계는 자궁경부암 환자의 5년간 생존률에도 크게 유의성이 있는 것으로 관찰되었다 (그림 2B). 즉, pAKT와 MKRN1이 높게 발현되고 PTEN의 발현이 낮게 유지되는 자궁경부암 환자일수록 5년 생존률이 현저히 낮은 것이다. 이러한 결과를 기반으로 하여, PI3K/AKT가 MKRN1을 활성화시켜 PTEN의 단백질 수준을 저해함으로써 암 발생을 유도하고 암에서 PI3K/AKT 신호가 강력하게 유지될 수 있도록 하는 새로운 발암기전의 가능성을 확인하였고 이를 순차적으로 확인하였다.
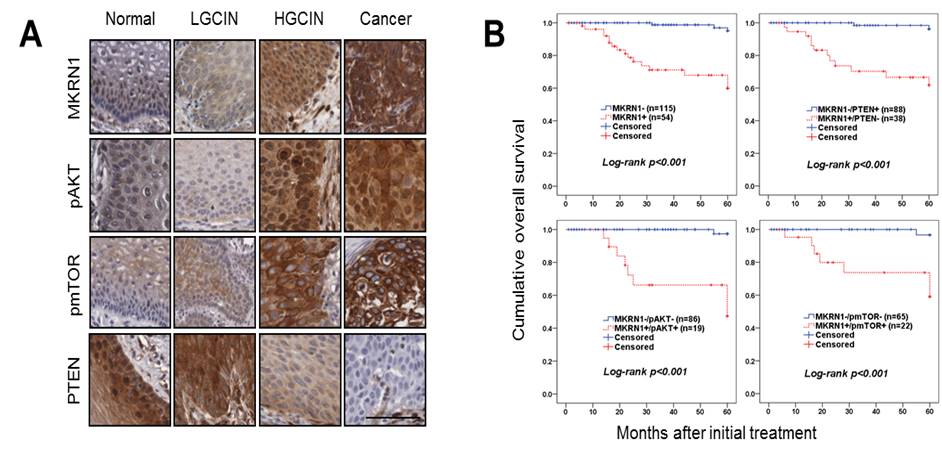
그림 2. Human Cervical Neoplasia에서 pAKT와 MKRN1, PTEN의 발현 및 분석
The Tissue Microarray(TMA)를 통해 190 Case의 자궁경부암 환자를 관찰하였다. Normal, Low-Grade CIN, High-Grade CIN and Invasive Cervical Cancer Tissues에서 Stage에 따라 pAKT, MKRN1을 증가하는 양의 관계를 PTEN의 경우 저해되는 음의 관계를 보였다 (A). 또한 pAKT, MKRN1이 높을수록, PTEN은 낮을수록 자궁경부암 환자의 Overall Survival이 좋지 못하였다 (B).
3. AKT에 의한 MKRN1의 인산화를 통한 활성
MKRN1 단백질에 종간 잘 보존된 AKT의 인산화 표적 단백질 서열이 존재함을 확인하고, MKRN1의 Serine 109에 AKT에 의한 인산화가 일어날 수 있음을 증명하였다 (그림 3A, B). 이러한 PI3K/AKT에 의한 MKRN1의 인산화가 MKRN1의 단백질 안정화 및 활성화를 유도할 수 있는지 확인하였다. 활성화된 AKT의 형태인 myr-AKT에 의해 MKRN1의 단백질 수준이 증가하고, MKRN1의 단백질 안정도(Stability)가 크게 증가함을 확인하였다 (그림3 C, D). 또한, AKT에 의한 인산화가 MKRN1의 유비퀴틴화를 억제시켜 MKRN1의 단백질 수준을 증가시키는 것임을 다양한 분자적 실험을 통하여 증명하였다 (그림 3E). 결과적으로, PI3K/AKT신호의 새로운 신호단백질로 MKRN1이 인산화 되고 활성화 되는 것을 관찰하였고, 이는 환자 및 암세포 주의 pAKT와 MKRN1의 양의 관계를 설명하고 있다.
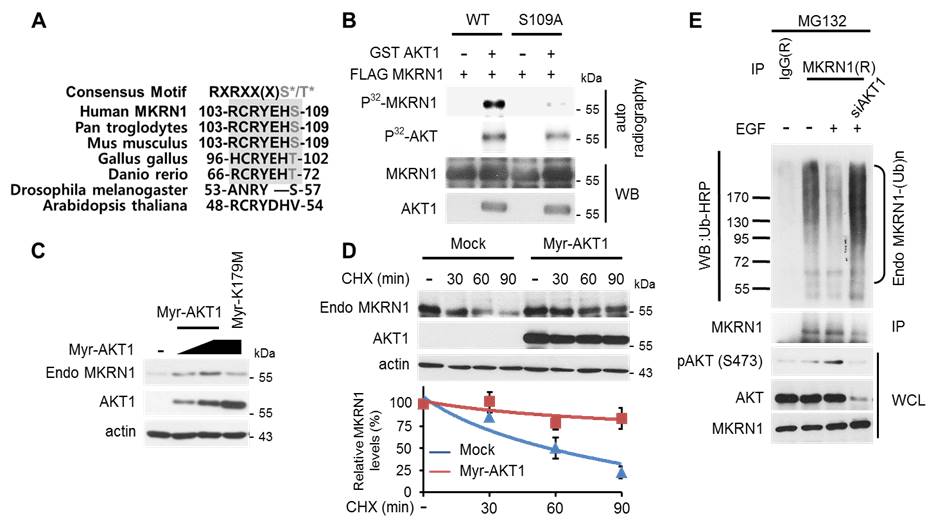
그림 3. AKT에 의해 유도되는 MKRN1의 인산화 및 안정화
MKRN1의 AKT 인산화 표적 단백질 서열 (A). in vitro에서 AKT에 의해 MKRN1의 109번째 Serine이 인산화됨을 확인하였다 (B). myr-AKT에 의해 MKRN1의 단백질 수준이 증가하고, 단백질 안정도가 증가함을 확인하였다 (C, D). 표피생장인자 EGF(Epidermal Growth Factor)에 의해 활성화된 AKT가 MKRN1의 유비퀴틴화를 억제함을 확인하였다 (E).
4. 활성화된 PI3K/AKT에 의해 안정화된 MKRN1은 PTEN을 유비퀴틴화 및 분해함
생장인자 EGF, PI3K의 발암 Mutation, myr-AKT와 같은 발암신호가 PI3K/AKT를 활성화 시켜 MKRN1의 안정화를 유도함을 확인하였고, 이렇게 활성화된 MKRN1이 PTEN의 유비퀴틴 결합효소로 작용할 수 있는지 확인하였다. MKRN1은 PTEN의 단백질 분해 및 안정도(Stability)를 저해시키고, 강력하게 유비퀴틴화를 일으키는 것을 확인하였다 (그림 4 A-D) 또한, EGF에의해 활성화된 PI3K/AKT/MKRN1 신호가 PTEN의 유비퀴틴화를 유도함을 관찰하였다 (그림 4E, F).
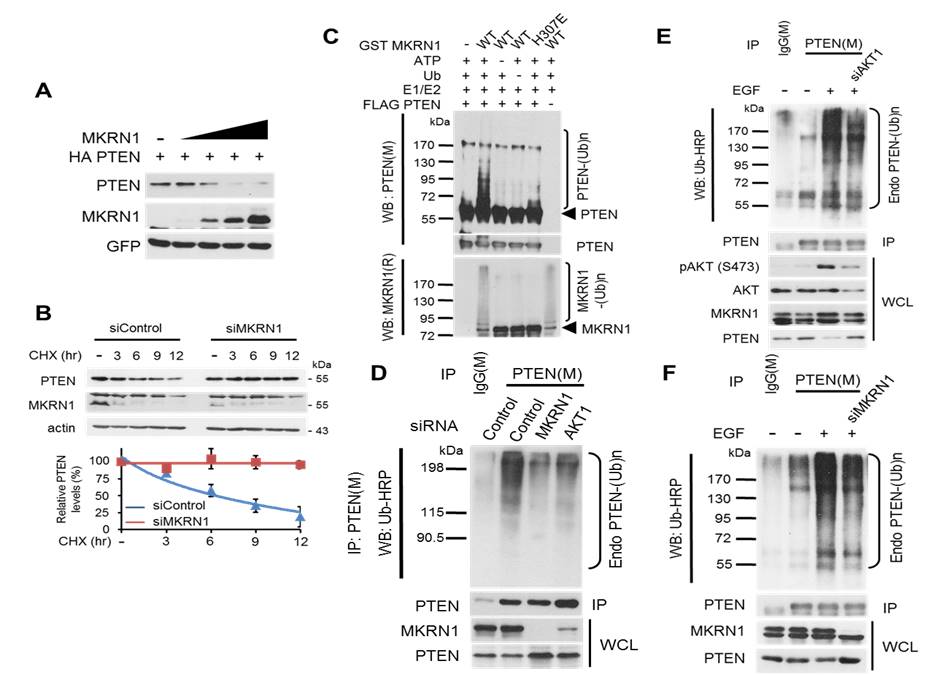
그림 4. PTEN의 새로운 E3-Ligase MKRN1
MKRN1의 발현으로 PTEN의 단백질 분해가 유도되고 단백질 안정도가 조절됨을 확인하였다 (A, B). MKRN1이 PTEN의 유비퀴틴화를 유도할 수 있음을 확인하였다 (C, D). EGF에 의해 활성화된 AKT/MKRN1에 의해 PTEN의 유비퀴틴화 및 분해가 유도됨을 확인하였다 (E, F).
5. 암 발생에서 MKRN1에 의한 PTEN 조절의 중요성
앞선 연구들을 바탕으로 MKRN1이 억제된 자궁경부암 세포 주를 쥐에 이식하여 발암능력에 기여하는 MKRN1의 역할을 확인하였다 (그림 5).
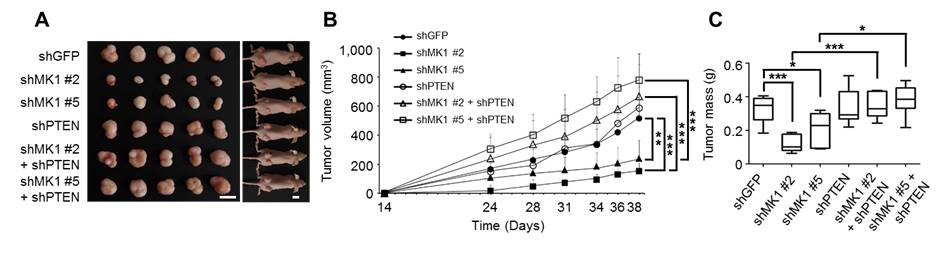
그림 5. MKRN1의 억제는 자궁경부암 발생 및 성장을 저해함
자궁경부암 세포 주에 shRNA를 통해 MKRN1, PTEN을 억제시킨 후, 쥐에 주입하여 암 발생을 유도한 후 크기 및 무게를 관찰하였다.
연구의 성과 및 의의
본 연구를 통해 다양한 발암신호(Oncogenic Stress)에 의해 활성화되는 PI3K/AKT 신호가 인산화 시키는 새로운 표적 단백질로 MKRN1을 관찰하였으며, 이러한 인산화는 MKRN1의 단백질 안정화, 기능적 활성화를 유도함을 확인함으로써 PI3K/AKT/MKRN1에 이르는 새로운 발암신호전달을 밝혔다. 또한 PI3K/AKT/MKRN1 신호전달은 암 억제 단백질이자 PI3K/AKT 신호의 가장 강력한 억제 단백질인 PTEN을 직접적으로 유비퀴틴화 및 분해시킨다. 이러한 과정을 통하여 암에서 발암신호(Oncogenic Stress)에 의해 활성화된 PI3K/AKT 신호를 스스로 강력하게 유지시킬 수 있는 것으로 생각된다 (그림 6). 이러한 Positive Feedback Loop는 발암신호가 직접적으로 PTEN의 단백질 수준을 조절할 수 있다는 새로운 정보를 제공하고, PI3K/AKT 신호의 억제를 통한 암 치료 연구 분야에 중요한 학문적 기반을 제시할 것으로 기대하고 있다.
이와 더불어 자궁경부암 환자에서 분석된 pAKT, MKRN1, PTEN의 발현 유의성과 자궁경부암 환자의 생존률 정보를 통해 자궁경부암의 새로운 바이오마커로서 MKRN1의 가능성과 자궁경부암 치료 표적으로서 PI3K/AKT 신호의 가능성을 제시하였다.
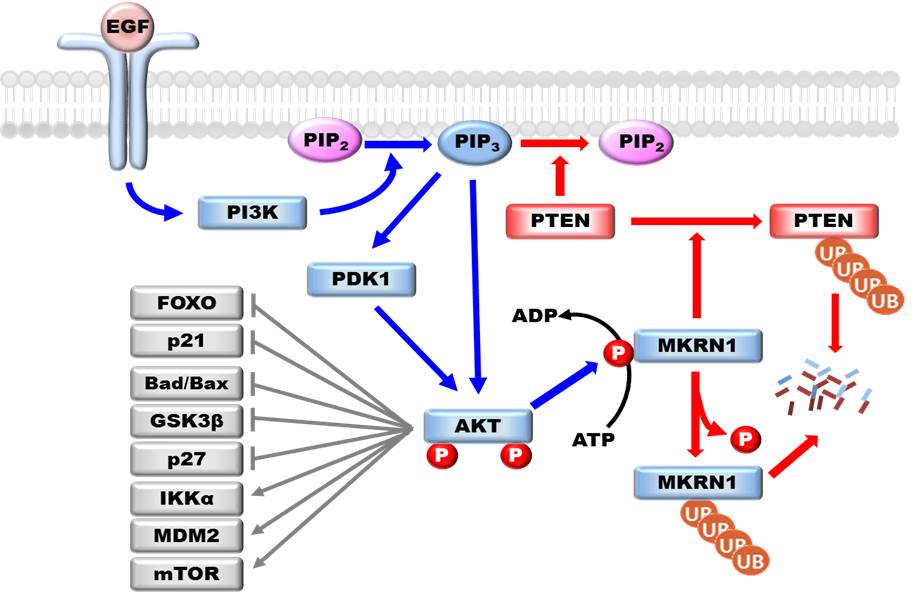
그림 6. PI3K/AKT/MKRN1과 PTEN억제를 통한 Positive Feedback 모델
참고문헌
1. Li, J. et al. (1997) PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer.
Science 275, 1943–1947
2. Hopkins, B. D., Hodakoski, C., Barrows, D., Mense, S. M. & Parsons, R. E. (2014) PTEN function: the long and the short of it.
Trends Biochem Sci 39, 183–190
inputs during tumorigenesis. Nat Rev Cancer 6, 184–192
4. Song, M. S., Salmena, L., Pandolfi, P. P. (2012) The functions and regulation of the PTEN tumour suppressor. Nat Rev Mol
Cell Biol 13, 283–296
5. Blumenthal, G. M., Dennis, P. A. (2008) PTEN hamartoma tumor syndromes. Eur J Hum Genet 16, 1289–1300
6. Wang, X., Jiang, X. (2008) Post-translational regulation of PTEN. Oncogene 27 5454–5463
7. Fata, J. E., Debnath, S., Jenkins, Jr. E. C., Fournier, M. V. (2012) Nongenomic mechanisms of PTEN regulation. Int J Cell Biol
2012, 379685
8. Trotman, L. C. et al. (2007) Ubiquitination regulates PTEN nuclear import and tumor suppression. Cell 128, 141–156
9. Shi, Y., Paluch, B. E., Wang, X., Jiang, X. (2012) PTEN at a glance. J Cell Sci 125, 4687–4692
10. Zhang, J. et al. (2013) Deubiquitylation and stabilization of PTEN by USP13. Nat Cell Biol 15, 1486–1494
첨부파일