
생화학분자생물학회입니다.
퇴행성뇌질환 극복을 위한 신약개발과 바이오마커 연구
작성자
관리자작성일자
2016-01-01조회수
526퇴행성뇌질환 극복을 위한 신약개발과 바이오마커 연구
![1450266710_1월호 [Translationa Research]-저자사진.bmp](https://www.ksbmb.or.kr/data/ksbmb_data/images/smarteditor/1450266710_1월호%20[Translationa%20Research]-저자사진.bmp)
강 주 희
johykang@inha.ac.kr
인하대학교 의과대학 약리학교실
저산소 표적질환 연구센터
서론
퇴행성뇌질환(Neurodegenerative Diseases)이라 함은 점진적으로 악화되는 진행성 신경기능 또는 구조의 소실에 의해 신경세포의 사멸과 퇴행이 나타나는 질환군을 일컬으며, 대표적으로는 인지장애를 동반하는 치매(Dementia; ‘치매[어리석을 치 ‘癡’, 어리석을 매 ‘呆’]’보다는 ‘인지장애증’이라는 용어의 사용이 옳지만 독자의 이해를 돕기 위해 이 글에서는 치매라고 표현하겠다)와 Tremor, Bradykinesia, Rigidity와 같은 운동기능장애를 나타내는 Parkinson’s Disease(PD)가 있다. 치매는 전체 치매의 약 60-70%를 차지하는 Alzheimer’s Disease(AD)를 비롯하여 전측두엽(Frontotemporal Lobe)이 망가지는 전측두엽치매(Frontotemporal Lobar Degeneration; FTLD)와 혈관성 치매(Vascular Dementia), 루이소체치매(Dementia with Lewy Bodies) 등이 있다. 그러나 불행하게도 이들 퇴행성뇌질환의 치료를 위해 현재까지 질환의 진행을 억제하는 소위 ‘Disease-Modifying Drug(DMD)’은 개발되지 못하였다. AD의 경우 아세틸콜린성 신경전달을 강화하여 인지기능을 향상시키는 Acetylcholinesterase 억제제인 Rivastigmine, Galantamine, Donepezil 같은 약물과 NMDA 수용체 억제제인 Memantine이 사용되고 있지만 AD의 진행을 멈추거나 늦추지는 못한다. PD의 경우에도 도파민을 강화하기 위한 약물들(Carbidopa, Bromocriptine, Ropinirole, Pramipexole, Selegiline 등)을 사용하여 운동기능 이상을 보정할 수는 있지만 질병의 자연사(Natural History)를 바꾸지는 못한다. 이외의 퇴행성뇌질환에서도, 루게릭병으로 불리는 Amyotrophic Lateral Sclerosis, 헌팅턴병(Huntington’s Disease), 크로이츠펠트-야코프병(Creutzfeldt-Jacob Disease)의 치료제도 개발되지 못하였다.
AD는 20세기가 시작되던 1901년 독일의사 Alois Alzheimer 박사가 처음으로 50세 환자를 진단한 이후 100년이 넘었지만 아직까지 DMD는 개발되지 못하였다. 그렇다면 왜 이토록 오랜 기간 동안 AD를 정복할 수 없었을까? 그 이유는 여러 가지가 있겠으나, 신약개발의 타겟이 되면서 질병을 일찍 진단할 수 있는 수단이 없었기 때문이다. 다양한 종류의 바이오마커는 이러한 신약개발의 장벽을 허물 수 있는 유용한 수단이 될 수 있다. 효율적인 신약개발을 위한 임상시험 연구에서 1980년대까지는 주로 ‘Pharmacologic Research’가 최대 관심사였으며 1990년대까지는 ‘Pharmacokinetic-Pharmacodynamic Research’가 주를 이루었고, 2000년대 까지는 ‘Pharmacogenetic(-Genomic) Research’가 주요 연구분야를 이루었다. 21세기에 들어서면서 신약개발의 주요 관심사는 ‘Biomarker Research’로 옮겨가고 있다. 바이오마커라 함은 ‘정상적인 생리기능, 질환의 병리적 특성, 또는 약물반응을 객관적으로 측정할 수 있는 것 (A characteristic that is objectively measured and evaluated as an indicator of normal biologic processes, pathologic processes, or pharmacologic responses to a therapeutic intervention)’으로 정의된다. 저자는 그 간의 연구경험을 바탕으로 최근 퇴행성뇌질환 극복을 위한 신약개발에서 바이오마커가 어떻게 활용되고 있는지를 소개하고 앞으로의 전망과 과제를 제시하고자 한다.
본론
대표적 퇴행성뇌질환 바이오마커: AD 바이오마커
퇴행성뇌질환에서 바이오마커의 종류는 매우 다양하겠으나, 현재까지 임상적으로 ‘Validation’이 비교적 충분하게 되어 있는 AD 바이오마커를 예를 들어 설명하고자 한다. AD에 대해 간단히 설명하자면, AD는 병리학적으로 뇌 조직에 두 가지 전형적인 병리특징(Pathologic Hallmark)을 보이는데, 하나는 세포 외에 침착되어 있는 Amyloid Plaque(AP)과 신경세포 내에서 관찰되는 Neurofibrillary Tangle(NT)이다. 따라서 바이오마커의 정의에 따르면 AP를 구성하고 있는 Amyloid-Beta(Ab) 단백질과 NT를 구성하는 tau 단백질과 인산화 tau 단백질(phosphorylated tau; p-tau)이 가장 적합한 바이오마커가 될 것이다. AD 바이오마커가 정량적으로 측정되어 임상연구에 활용되기 시작한 것은 1990년대 Kaj Blennow 연구팀이 면역측정법을 보고한 이후부터이다 (1-3). 즉, 뇌의 분자적 특성을 가장 잘 반영하는 척수액(Cerebrospinal Fluid; CSF)에서 ELISA법을 이용하여 Ab1-42, total tau(t-tau)와 p-tau를 정량함으로써 가능하게 되었다. AD 환자의 뇌에는 AP에 Ab가 축적됨으로써 CSF의 Ab1-42 농도는 감소하고 신경세포 사멸에 의해 tau가 유리됨으로써 CSF t-tau와 p-tau 농도는 증가하는 특성을 보인다. 많은 임상연구들이 CSF Ab1-42 농도감소와 tau 단백질의 농도 증가를 AD 환자에서 관찰하였으며, 미국 National Institutes of Health(NIH)의 주도로 2004년부터 시작되어 현재도 진행되고 있는 Alzheimer’s Disease Neuroimaging Initiative(ADNI) 연구에 의해 검증이 이루어 졌다. ADNI 연구결과에 의하면 CSF Ab1-42/t-tau 농도비가 진단정확도(민감도와 특이도) 뿐만 아니라 AD 전단계로 생각되고 있는 경도인지장애(Mild Cognitive Impairment; MCI) 환자의 AD 진행 예측도(Positive and Negative Predictive Value)가 85% 정도로 임상 적용이 가능함을 보여 주었다 (4). 현재 실험실 간 Ab1-42와 tau 단백질 측정치의 변이(Inter-Laboratory Variability)와 같은 몇 가지 이슈가 남아 있지만, 이러한 문제도 곧 극복이 될 전망이다.
높은 진단정확도와 질병진행 예측도에도 불구하고 CSF AD 바이오마커는 한계점을 가지고 있다. 대표적인 한계점으로는 CSF 채취를 위한 요추천자(Lumbar Pucture; LP)가 필요한데 LP는 혈액채취보다 매우 침습적이라는 점이다. 일반적으로 알려진 바와 같이 LP가 심각한 시술 부작용을 발생시키지는 않음에도 불구하고, 특히 국내 환자와 보호자들은 LP를 받기를 꺼려한다. 실제로 미국에서도 ADNI 연구가 시작되는 시점에서는 피험자의 50% 정도만이 LP에 동의하였다. 그러나 LP에 대한 꾸준한 홍보와 계몽으로 현재는 연구용 LP의 경우 거의 90%가 넘는 환자들이 LP에 동의한다. 그럼에도 불구하고 여전히 LP보다는 혈액 바이오마커에 기반한 진단이 CSF 바이오마커보다는 유리하다. 그러나 불행하게도 현재까지 AD 진단을 위한 혈액 바이오마커는 개발되어 있지 않다. 다수의 임상, 비임상 연구에서 여러 종류의 AD 혈액 바이오마커가 제시되었으나 아직까지 CSF AD 바이오마커와 같이 임상적으로 검증이 되어 있는 혈액 바이오마커는 없다. 국내에서도 일부 연구자들이 혈액에서 매우 유용한 AD 바이오마커를 ‘개발’하였다고 주장하지만, 그것은 어디까지나 ‘발굴’ 단계라고 보는 것이 타당하다. 왜냐하면, 현재까지 제시되었던 AD 혈액 바이오마커들이 ‘개발’되기 위해서는 대규모 임상연구에서 임상효용성이 검증되어야 하기 때문이다. AD의 발병과 진행에 대해서는 현재까지 ‘아밀로이드 가설(Amyloid Hypothesis)’가 가장 유력한 가설이며, 아밀로이드 가설은 Ab의 생성과 제거에 이상이 생겼을 경우에 단일체보다 더 독성이 있는 Ab 중합체(Oligomer)가 생성되고 AP로 진행되는 과정에서 다양한 신경세포 독성과 염증반응을 일으킨다는 것이다 (5, 6). 또한 아밀로이드의 병리적 변화가 tau 인산화와 Microglial Activation과도 밀접하게 연관되어 다양한 병리현상을 증폭시킬 수 있다. 따라서 향후 AD 병리기전에 기반한 혈액 바이오마커가 ‘개발’될 경우 CSF 바이오마커와 함께 신약개발 단계에서 매우 유용한 바이오마커가 될 것이다.
신약개발 임상시험에서 퇴행성뇌질환 바이오마커의 활용
AD 치료제 개발의 경우 DMD를 추구하는 임상시험 신약의 ‘Enhancing Target Engagement’, ‘Sample Selection and Enrichment’ 및 ‘Prevention Trial’의 목적으로 수 년 전부터 비로소 임상시험 계획 단계에서 CSF AD 바이오마커가 포함되기 시작하였다. 더욱이 최근에 연구용 AD 진단기준에 바이오마커가 추가된 것이 임상시험에 바이오마커를 활용하는 것을 촉진시키고 있다. 즉, 임상시험에서 피험자의 CSF를 채취하여 AD 바이오마커의 양적 변화를 측정함으로써 개발 신약이 실제 뇌 병리현상의 변화를 유도하는지를 검증하거나, AD 초기 환자 또는 MCI 환자를 CSF 바이오마커를 기반으로 선택함으로써 환자군의 병리적 균질성을 확보하기 위해 사용되고 있다. 예를 들어 Ab를 타겟으로 하는 Solanezumab에 대한 EXPEDITION 3상 임상시험에서는 CSF Ab의 양적 변화를 측정하여 Ab 항체약물인 Solanezumab이 실제 Ab의 양적 변화를 유도하는지를 검증하고 있다. 이외에도 매우 다양한 종류의 AD 치료약물이 CSF AD 바이오마커를 활용하고 있으며, PD 치료약물 개발에서도 바이오마커를 활용하고 있다 (그림 1).
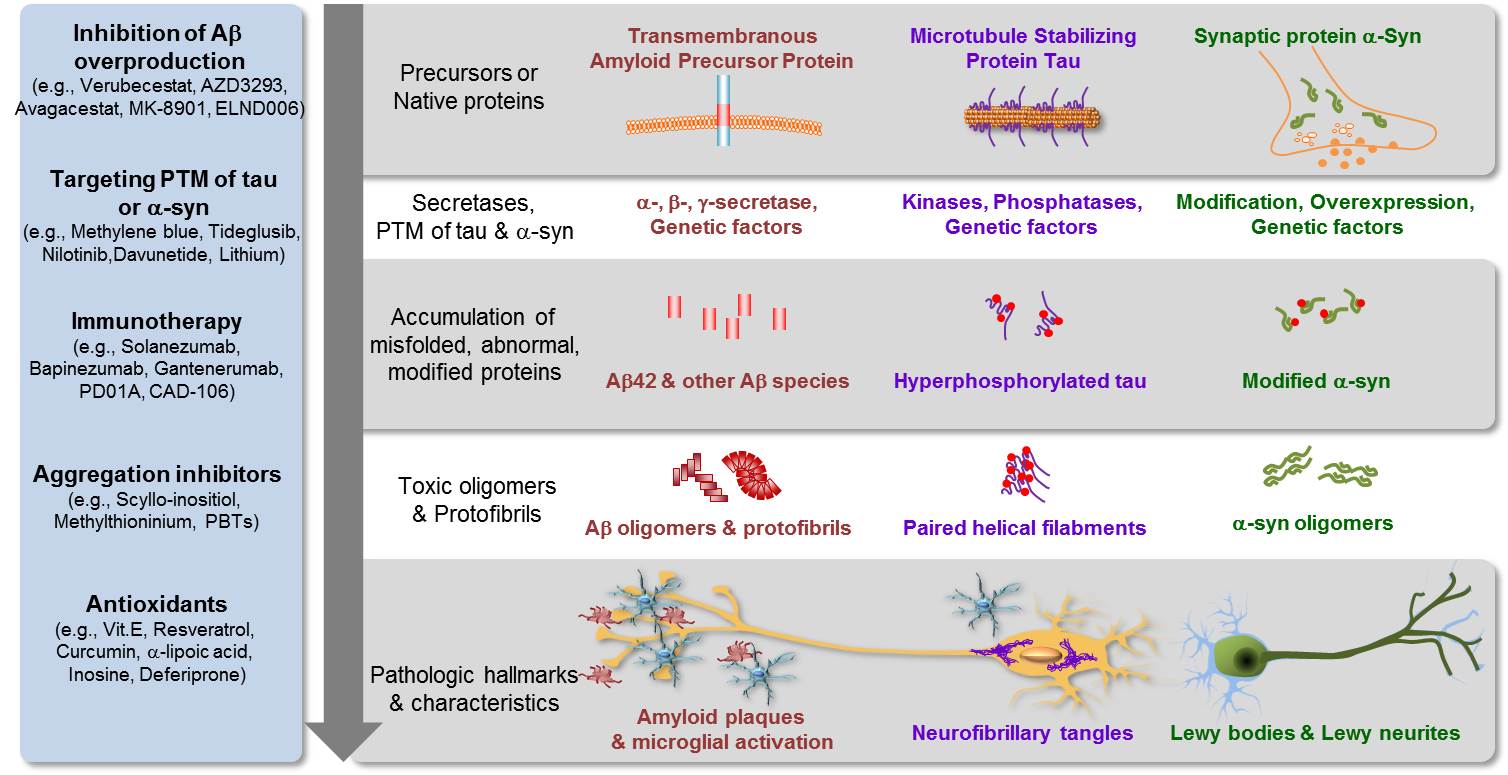
그림 1. 퇴행성뇌질환 병리기전과 바이오마커에 따른 신약개발 현황
퇴행성뇌질환은 질환의 특성이 매우 장기적이고 서서히 병리적 변화가 진행되어 개발되는 신약이 임상효능을 나타내는지를 검증하기 위해서는 매우 오랜 기간 동안 환자의 치료효과를 모니터링 해야 한다. 더욱이 임상증상이 나타나는 단계까지 이미 신경퇴행이 많이 진행되어 있는 경우에는 이를 되돌리기는 매우 어렵다. 따라서 신약개발의 성공을 위해서는 임상증상이 나타나기 전에 미리 환자의 질병 발생과 진행을 예측할 수 있는 바이오마커의 개발이 필수적이라 할 수 있다. AD의 경우 임상증상이 나타나기 15-20년 전부터 뇌에서는 병리변화가 시작된다고 알려져 있다 (7). 따라서 뇌의 병리 변화를 임상증상이 나타나기 전에 바이오마커를 통해 미리 알 수 있다면 예방적 치료개념을 적용하는 신약개발에 활용될 수 있을 것이다. PD의 경우에도 마찬가지로 흑질의 도파민 신경세포의 50-70% 이상이 사멸된 이후에 비로소 운동이상 징후가 발생되기 때문에, 이를 미리 예측하는 바이오마커는 신약개발에 유용하게 활용될 수 있다. PD 바이오마커로서 CSF Alpha-Synuclein, DJ-1, Flt3 Ligand 등이 제시되고 있으나 (8, 9), 임상 진단정확도와 예측도가 낮아 지금까지 유용한 바이오마커는 개발되어 있지 않다.
유전자 바이오마커를 제외한 생화학적 바이오마커를 활용한 퇴행성뇌질환의 진단은 환자와 정상인을 구분할 수 있는 특정 ‘Cut-Off Value’를 적용하는 방식이다. 예를 들어, xMAP-Luminex Multiplex Platform을 이용하여 ADNI 연구를 통해 결정된 ‘Cut-Off Value’인 CSF Ab1-42 값 192 pg/mL을 기준으로 그 이하이면 AD로 진단하는 방식이다 (4). 그러나 이러한 ‘Cut-Off Value’의 적용에서 유념해야 할 점은 필연적으로 동반되는 측정값의 변이(Variability)를 포함하는 정밀도(Precision)이다. AD CSF 바이오마커의 경우에도 임상시험을 위한 피험자 모집에서 특정 ‘Cut-Off’를 적용할 경우 실제로는 AD가 아닌 사람이 AD 군에 포함될 수도 있고, AD 환자가 정상인 군에 포함될 수도 있다. 따라서 진단 ‘Cut-Off Value’를 기준으로 ‘Grey Zone’을 설정하여 피험자를 모집할 필요성이 제기되고 있다 (그림 2). 즉, ‘Cut-Off Value’를 기준으로 상하로 일정기준(예: 95% Confidence Interval)을 정하여 그 이상과 이하에 해당하는 사람들을 환자와 정상인군으로 모집할 필요가 있는 것이다. 이러한 과정을 통해 보다 정확한 환자/정상인 피험자 군의 모집이 가능하여 신약개발의 효율성과 성공가능성을 높일 수 있다. 또한 생화학적 바이오마커인 CSF Ab1-42와 tau의 측정 뿐만 아니라 유전자 바이오마커(예: ApoE 유전형)와 이미징 바이오마커와의 조합을 통한 정확도 향상방안에 대한 연구도 신약개발 활용을 위해 매우 유용하다.
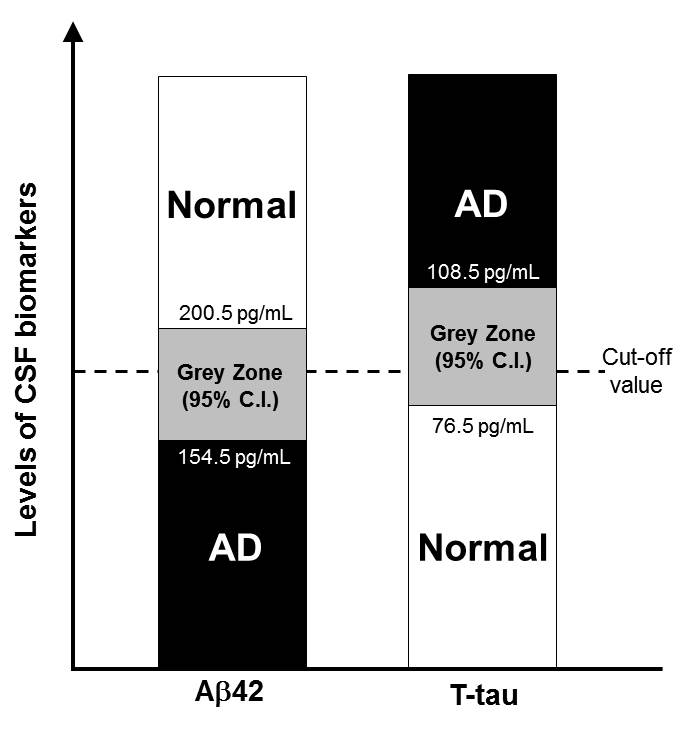
그림 2. AD CSF 바이오마커의 임상시험 활용에서 Grey Zone의 고려
퇴행성뇌질환 신약개발에서 바이오마커의 전망과 과제
위에서 언급한 바와 같이 앞으로 퇴행성뇌질환의 신약개발에서 바이오마커의 활용은 신약개발의 효율성과 성공가능성을 높이는 열쇠로 생각되고 있다. 이는 퇴행성뇌질환에만 국한된 것은 아니며, 거의 모든 질환의 신약개발에 적용되고 있다. AD를 중심으로 점차 바이오마커의 활용은 증가할 것이며, AD 신약개발에서 CSF 바이오마커 활용에 대한 경험은 다른 퇴행성뇌질환 신약개발에도 적극적으로 적용될 전망이다. 생화학적 바이오마커와 더불어 이미징 바이오마커(예: CT, MRI, amyloid-PET 등)도 매우 유용한 바이오마커이지만 비용측면에서 생화학적 바이오마커에 비하여 불리하다. 제약회사에서는 신약개발 비용을 낮추기 위해 가장 필요한 것 중의 하나가 효율적인 임상시험 설계를 통한 개발기간의 단축이다. 이를 위해서 퇴행성뇌질환 바이오마커의 활용은 더욱 촉진될 것이며, 이를 위해 학계, 산업계, 정부의 긴밀한 협조가 요구되고 있다. 유럽의 경우 EMA(European Medicines Agency)에서 CSF AD 바이오마커를 위한 면역측정법을 하나의 진단방법으로 승인하였고 미국 FDA(Food and Drug Administration)에서도 조만간 승인될 것으로 예상된다. 그러나 아직까지 국내에서는 CSF AD 바이오마커의 임상진단 활용이 완벽히 승인이 되지 않은 상태이므로, 이에 대한 충분한 논의와 준비가 필요하다. 충분한 임상연구 결과와 논의를 통해 바이오마커의 임상활용이 촉진된다면 퇴행성뇌질환 분야의 국내 신약개발이 활성화되는 계기를 마련할 수 있을 것이다. AD 신약개발의 측면에서 보면 현재 대한민국 국민의 기대수명이 평균 82세인데, AD 환자에서 75세 이상이 차지하는 비율은 80%에 달한다. 미국에서 2030년 AD 환자는 8.4백만 명에 이를 것으로 예측되고 있고 (10), 이러한 당면 위기에 대응하기 위해 2011년 오바마 대통령은 National Alzheimer’s Projects Act에 서명하였으며, AD 신약개발에 다국적 제약회사들은 총력을 기울이고 있다. 이러한 위기의 직면은 국내도 예외는 아니며, 관련 분야의 경쟁력을 확보하기 위해서는 지금보다 더 과감한 정부차원의 투자가 필요한 시점이다.
임상시험에서의 활용뿐만 아니라, 퇴행성뇌질환 바이오마커 연구는 새로운 치료타겟을 발굴하고 검증하는 매우 중요한 연구방법론이 될 것이다. 이를 위해서 in vitro 연구와 비임상 연구를 통해 새로이 발굴되는 바이오마커들은 임상연구를 통해 임상효용성이 반드시 검증되어야 하며, 이는 신개념의 신약개발로 이어지는 초석이 될 것이다. 저자가 퇴행성뇌질환 바이오마커 개발을 위한 국제적인 임상연구에 참여하면서 절실히 느낀 것은 국내 연구자들에 비하여 바이오 선진국의 연구자들은 바이오마커의 ‘발굴’보다는 임상활용을 위한 ‘개발’에 더 초점을 맞추고 있다는 것이다. 즉, 병리기전에 기반하여 발굴한 다양한 종류의 바이오마커를 대규모 임상연구를 통해 임상효용성을 검증함으로써 실제 임상에 활용될 수 있는 수단으로 개발하는 것이다. 이는 신약개발과 필연적으로 연계될 수 있기 때문에 막대한 부가가치를 창출하는 전략이 된다. 국내에서도 이와 같이 바이오마커의 ‘발굴’과 더불어 ‘개발’에 지금보다 많은 역량이 집중되고 투자된다면 국내의 우수한 임상시험 인프라를 기반으로 한 단계 도약하는 시점이 도래할 것으로 기대한다. 특히 임상과 기초가 연계되어 임상현장에서의 연구결과와 임상적 현상이 기초 연구를 통해 검증되고 다시 임상연구로 Feedback 되는 ‘중개연구적 연구방법론’ 적용이 필연적이라 하겠다.
결론
퇴행성뇌질환의 극복을 위한 신약개발은 눈앞에 다가와 있는 초고령사회의 사회경제/보건의료적 문제를 대처하기 위한 필연적 과제이다. 퇴행성뇌질환은 질병이 서서히 진행되는 특징으로 인해, 수년간의 임상증상 모니터링을 통한 신약의 효능 입증기간이 소요된다. 따라서 효율적인 임상시험의 설계를 위해 임상검증이 완료된 바이오마커의 활용성이 매우 큰 분야이며, 현재 매우 많은 AD 신약 임상시험에서 바이오마커가 적용되고 있다. 그럼에도 불구하고 동 분야에 대한 국내 연구 투자는 선진국에 비하여 매우 미흡하며, 전문가도 많지 않은 실정이다. 이를 극복하기 위해서는 임상의사 연구자들의 전국적 코호트와 연구 네트워크의 구축, 기초연구자들의 바이오마커 발굴연구 네트워크 구축과 더불어, 신약개발 촉진을 위한 바이오마커 검증과 표준화 네트워크의 구축이 필요해 보인다. 또한 개별적이고 산발적으로 발굴되고 있는 바이오마커의 효율적 개발과 임상활용을 위한 산‧학‧병-정부 간 긴밀한 협조가 필요하다. 최근 치매를 대상으로 전국적인 연구 네트워크의 구축 노력이 진행되고 있는 것은 매우 고무적이지만, 비교적 단기간에 연구결과를 요구하는 것은 자칫 태동하는 관련 연구를 저해하는 요소가 될 수 있다. 따라서 정부 주도의 장기적 연구개발 계획을 세우고 지속적인 투자가 필요한 시점이다. 저자의 연구실도 퇴행성뇌질환 극복을 위한 AD와 PD 바이오마커 개발에 참여한 국제연구 경험을 바탕으로 국내 바이오마커 중개연구와 신약개발 분야에 이바지하고자 노력하고 있다. 여러 연구자들의 노력이 가까운 시일 내에 새로운 개념의 신약개발과 바이오마커 개발이라는 결실을 맺기를 기대한다.
참고문헌
1. Vandermeeren, M., Mercken, M., Vanmechelen, E., et al. (1993) Detection of tau proteins in normal and Alzheimer’s disease
cerebrospinal fluid with a sensitive sandwich enzyme-linked immunosorbent assay. J Neurochem 61:1828-1834.
2. Motter, R., Vigo-Pelfrey, C., Kholodenko, D., et al. (1995) Reduction of b-amyloid peptide42 in the cerebrospinal fluid of
patients with Alzheimer’s disease. Ann Neurol 38:643-648.
3. Andreasen, N., Hesse, C., Davidsson, P., et al. (1999) Cerebrospinal fluid b-amyloid(1-42) in Alzheimer disease; differences
between early- and late-onset Alzheimer disease and stability during the course of disease. Arch Neurol 36:673-680.
4. Shaw, L.M., Vanderstichele, H., Knapik-Czajaka, M., et al. (2009) Cerebrospinal fluid biomarker signature in Alzheimers Disease
Neuroimaging Initiative subjects. Ann Neurol 65:403-413.
5. Blennow, K., Hampel, H., Weiner, M., Zetterberg, H. (2010) Cerebrospinal fluid and plasma biomakers in Alzheimer disease. Nat
Rev Neurol 6:131-144.
6. Kang, J.H., Korecka, M., Toledo, J., Trojanowski, J.Q., Shaw, L.M. (2013) Clinical utility and analytical challenges in
measurement of cerebrospinal fluid amylid-b1-42 and t proteins as Alzheimer disease biomarkers. Clin Chem 59:903-916.
7. Bateman, R.J., Xiong, C., Benzinger T.L.S., et al. (2012) Clinical and biomarker changes in dominantly inherited Alzheimer’s
disease. N Engl J Med 367:795-804.
8. Shi, M., Bradner, J., Hancock, A.M., et al. (2011) Cerebrospinal fluid biomarkers for Parkinson disease diagnosis and
progression. Ann Neurol 69:570-580.
9. Kang, J.H., Irwin, D.J., Chen-Plotkin, A.S., et al (2013) Association of cerebrospinal fluid b-amyloid1-42, t-tau, p-tau181 and
a-synuclein levels with clinical features of drug-naive patients with early Parkinson disease. JAMA Neurol 70:1277-1287.
10. Hebert, L.S., Scherr, P.A., Bienias, J.L., et al. (2003) Alzheimers disease in the U.S. population: Prevalence estimates using
the 2000 Census. Arch Neurol 60:1119-1122.
첨부파일