
생화학분자생물학회입니다.
흥분성 시냅스 형성을 조절하는 nArgBP2의 역할 규명
작성자
관리자작성일자
2016-12-01조회수
521흥분성 시냅스 형성을 조절하는 nArgBP2의 역할 규명
nArgBP2 Regulates Excitatory Synapse Formation by Controlling Dendritic Spine Morphology
Proc Natl Acad Sci U S A. Jun 14;113(24):6749-54, 2016


이상은 장성호
서울대학교 의과대학 의과학과 서울대학교 의과대학 생리학교실/의과학과
sangeun45@snu.ac.kr sunghoe@snu.ac.kr
연구배경
Neural Abelson-Related Gene-Binding Protein 2(nArgBP2) 는 신경세포에 특이적으로 발현되는 단백질로, 세포 부착, 액틴세포골격 조직 및 성장인자 수용체의 하위신호전달 조절에 관여하는 Adaptor Protein Family에 속한다 (1, 2). 이들 단백질은 NH2 말단에 Sorbin Homology Domain과 COOH 말단에 세 개의 SH3 Domain을 갖는 것이 특징이다. 선행연구 결과, nArgBP2가 시냅스 단백질인 SAPAP과 결합하며 시냅스 후 구조인 Dendritic Spine의 형태 형성, 유지 및 가소성에 중요한 액틴세포골격을 조절하는 WAVE Complex 등과 같은 여러 단백질들과 상호작용한다는 것을 알게 되었다 (4).
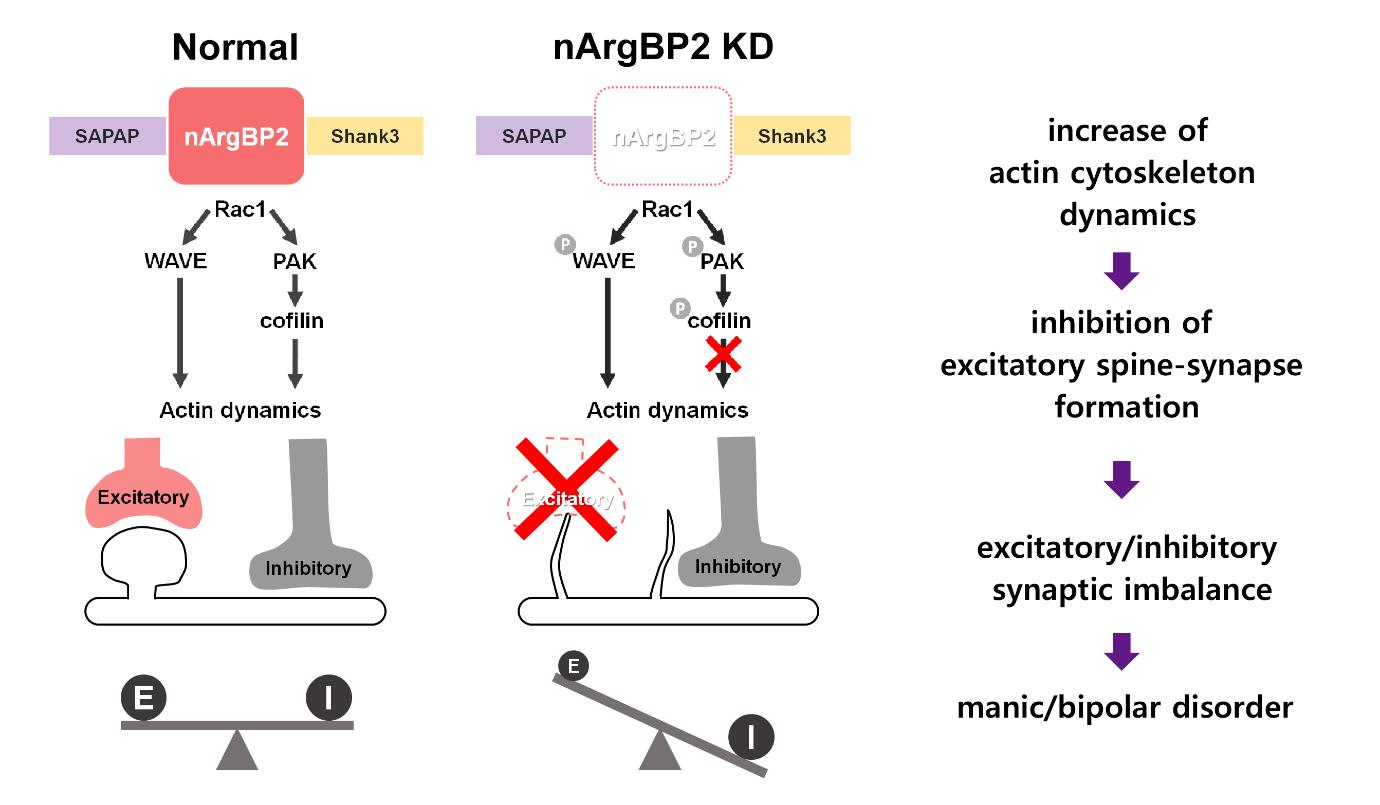
nArgBP2의 mRNA는 해마, 대뇌피질, 선조체, 시상 및 시상하부에 강하게 발현되며, 이는 대부분 조울증(Bipolar Disorder)과 관련된 뇌 영역이다 (3). 조울증은 기분장애(Mood Disorder)의 일종으로, 감정 조절의 이상으로 지적 활동은 물론 일상생활에까지 심각한 영향을 미치는 신경정신 질환이며 의욕상실, 체중 저하, 수면장애 등을 유발하는 우울증(Depression)의 증상과 더불어 그와 정반대 상태인 조증(Manic Episode)이 반복적으로 나타나는 것이 특징이다. 그러나 어떤 기작에 의하여 조울증이 유발되는가에 대해서는 전혀 알려져 있지 않았었다. 흥미롭게도 최근 nArgBP2가 Knock-Out된 마우스에서 조울증과 유사한 조증의 증상이 나타난다는 연구결과가 보고되었다 (5, 6). 또한, Shank3의 과발현이 Manic-Like Behavior를 나타내고 (7), 반대로 Shank3의 Knock-Out은 자폐증과 연관된다는 연구가 보고되었다 (8). Shank3는 SAPAP3와 결합하고, SAPAP3는 nArgBP2와 상호작용을 하므로, nArgBP2가 조울증, 자폐증 등 다양한 기분 장애의 발생의 허브 단백질로 역할을 할 가능성이 높음에도 불구하고, 실제 시냅스에서 nArgBP2의 역할이나 신경정신질환과 연관되는 시냅스 기능 장애와의 연관성에 대해서는 알려진 바가 없었다. 이에 본 연구진은 nArgBP2의 실제적인 역할과, nArgBP2가 결핍되었을 때 나타나는 시냅스 기능 이상의 분자적 메커니즘을 알아보고자 연구를 진행하였다.
연구결과
1. nArgBP2의 발현 위치 확인
신경세포에서 nArgBP2의 발현 양상을 확인하기 위해 Immunocytochemistry를 진행하였다. 그 결과 nArgBP2가 Dendritic Spine에서 흥분성 시냅스 단백질인 PSD95와 대부분이 Colocalize하는 (그림1 A) 반면, 억제성 시냅스 단백질인 Gephyrin과는 거의 겹치지 않는 것을 관찰하였다 (그림1 B). 따라서 nArgBP2가 특이적으로 흥분성 시냅스 내 Dendritic Spine에 발현된다는 것을 알 수 있었다.
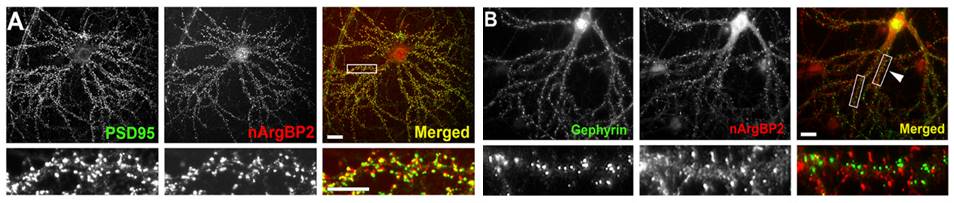
그림 1. nArgBP2는 특이적으로 흥분성 시냅스에 위치한다
신경세포에서 nArgBP2의 발현 위치를 확인해본 결과 흥분성 시냅스 단백질인 PSD95와는 대부분 겹쳐서 위치하고 (A), 억제성 시냅스 단백질인 Gephyrin과는 거의 겹치지 않았다 (B).
(Lee et al. Proc Natl Acad Sci U S A. 113(24):6749-54, 2016)
2. 신경세포에서 nArgBP2 Knock-Down에 의한 변화
신경세포에서 nArgBP2의 생리학적 역할을 알아보기 위해 shRNA를 이용하여 nArgBP2을 Knock-Down(KD)한 후 관찰하였다. 그 결과 정상적인 형태의 Mushroom-Shaped Dendritic Spine의 수가 현저히 감소한 반면 (그림2 A-B), 비정상적인 Filopodia 형태의 Dendritic Spine의 수가 증가한 것을 확인하였다 (그림2 A, C).
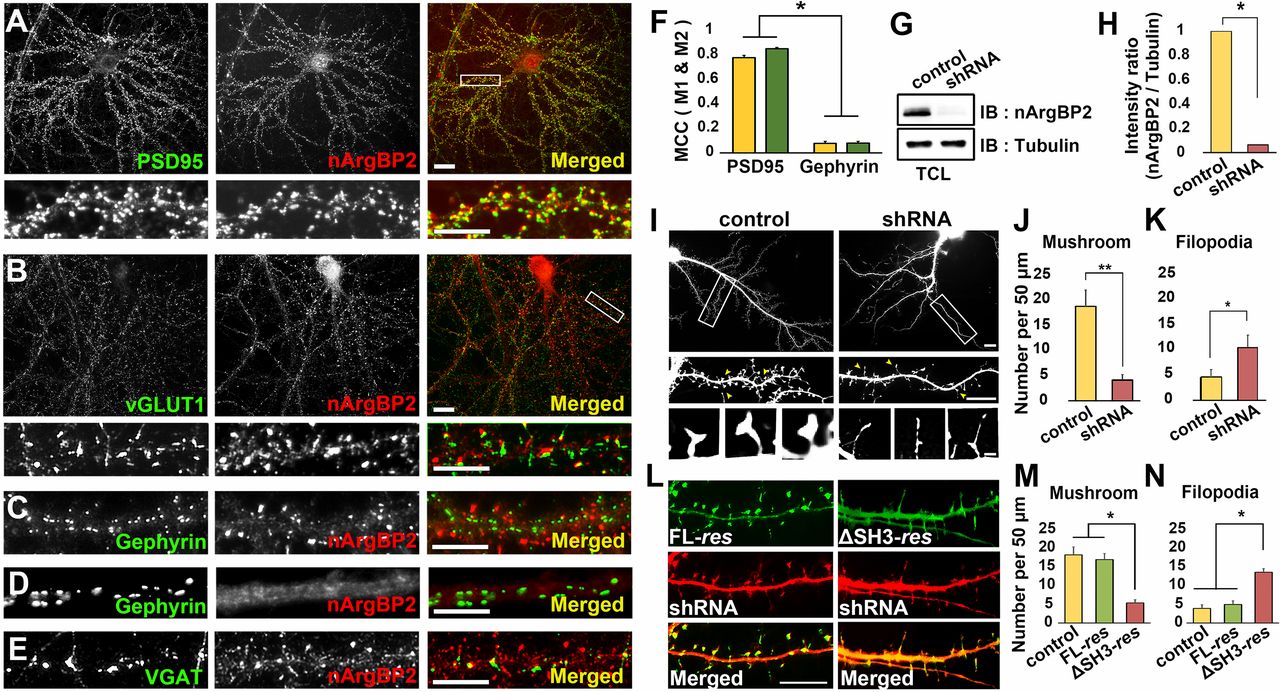
그림 2. nArgBP2가 Knock-Down(KD) 되었을 때 Dendritic Spine의 변화
shRNA를 이용하여 신경세포에서 nArgBP2의 발현을 억제한 결과 (A), Mushroom-Shaped Dendritic Spine의 수는 감소하고 (B), Filopodia의 수는 증가하였다 (C).
(Lee et al. Proc Natl Acad Sci U S A. 113(24):6749-54, 2016)
3. nArgBP2 KD에 의한 흥분성 시냅스 형성의 변화
중추신경계에서 신경세포 사이의 신호전달이 이루어지는 시냅스는 신경계 전체의 기능에 영향을 미친다. 시냅스는 전달되는 신호에 따라 흥분성 시냅스와 억제성 시냅스로 구분되며 이들 사이의 균형에 의해 전체 신경계의 기능을 유지한다. 따라서 nArgBP2 KD에 의해 흥분성 시냅스에서 신호를 전달받는 특이구조인 Dendritic Spine이 정상적으로 형성되지 않았을 경우, 시냅스 형성에는 어떠한 영향을 주는지 알아보기로 하였다.
Control Neuron과 KD Neuron을 각각 흥분성 시냅스 Marker인 vGLUT1과 PSD95, 또는 억제성 시냅스 Marker인 vGAT과 Gephyrin에 대한 Antibody로 염색 해본 결과, 흥분성 Spiny Neuron에서 Dendritic Spine에 형성되는 흥분성 시냅스의 수가 현저하게 감소하고 비정상적으로 Dendritic Shaft에 형성되는 흥분성 시냅스의 숫자가 증가한 반면 억제성 시냅스의 수에는 변화가 없었다 (그림3 A-B). 억제성 Aspiny Neuron의 경우 흥분성과 억제성 시냅스 모두 그 수가 Control과 다르지 않았다 (그림3 C-D).
흥분성 시냅스와 억제성 시냅스의 실제 기능에도 영향을 주는지 알아보기 위해 Miniature Excitatory/Inhibitory Postsynaptic Current를 측정해보았다 (그림3 E-H). 그 결과 mEPSC의 Frequency가 Control에 비해 감소하였으나, mIPSC의 Frequency나 Amplitude에는 변화가 없는 것을 알 수 있었다 (그림3 E-F). 따라서 nArgBP2가 특이적으로 흥분성 시냅스의 형성과 기능에 중요한 역할을 함을 확인할 수 있었다.
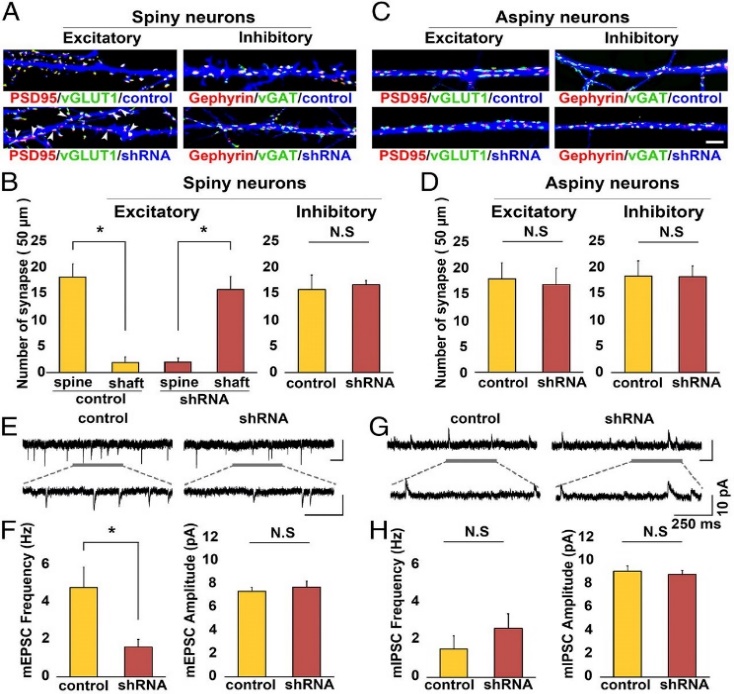
그림 3. nArgBP2 KD에 의한 흥분성 Spine-Synapse 형성의 이상
nArgBP2가 KD 되었을 때, Spiny Neuron에서 Spine에 형성되는 흥분성 시냅스의 수는 감소하고 (A) 억제성 시냅스와 Aspiny Neuron의 흥분성과 억제성 시냅스는 모두 영향을 받지 않았다 (B-D). 전기생리학적 실험을 통해 nArgBP2 KD이 mEPSC의 Frequency만 현저하게 감소하는 것을 확인하였다 (E-H).
(Lee et al. Proc Natl Acad Sci U S A. 113(24):6749-54, 2016)
4. nArgBP2에 의한 Actin 골격조절의 분자적 기전
nArgBP2가 KD되었을 때, 흥분성 시냅스의 특이구조인 Dendritic Spine이 비정상적으로 형성되고, 결과적으로 흥분성 시냅스가 정상적으로 형성되지 않았다. 이러한 형태적, 기능적 결함의 분자적 메커니즘을 알아보기 위해 Actin 골격에 관여하는 신호전달과정을 살펴보기로 하였다 (9, 그림 4). 그 결과 nArgBP2가 KD 되었을 때, Actin 골격의 활동성(Dynamics)을 조절하는 Rac1 Small GTPase의 하위 신호전달 단계에 있는 WAVE, PAK, Cofilin의 인산화가 유의하게 증가한 것을 확인하였다 (그림4 A-C). 이는 nArgBP2의 KD이 WAVE, PAK의 활성화와 Cofilin의 비활성화를 유발한다는 것을 의미한다. 이 결과를 실제로 Neuron의 Spine 형태변화에서 확인하기 위하여, nArgBP2가 KD된 Neuron에 WAVE와의 상호작용을 저해(mSH3-1/2; WAVE와 상호작용하는 1,2번째 SH3 Domain을 Mitochondria로 Targeting)한 상태에서 PID(PAK-Inhibitory Domain)으로 PAK을 저해하거나 (그림4 D-F), S3A(Active-Cofilin Mutant)로 Cofilin을 활성화 하였을 때 (그림4 D, G-H), Dendritic Spine에 나타났던 결함이 Control 수준으로 회복되는 것을 확인하였다. 이로써, WAVE/PAK/Cofilin의 과도한 인산화가 nArgBP2 KD Neuron에서 보였던 Dendritic Spine 형태변이의 원인임을 밝혔다.
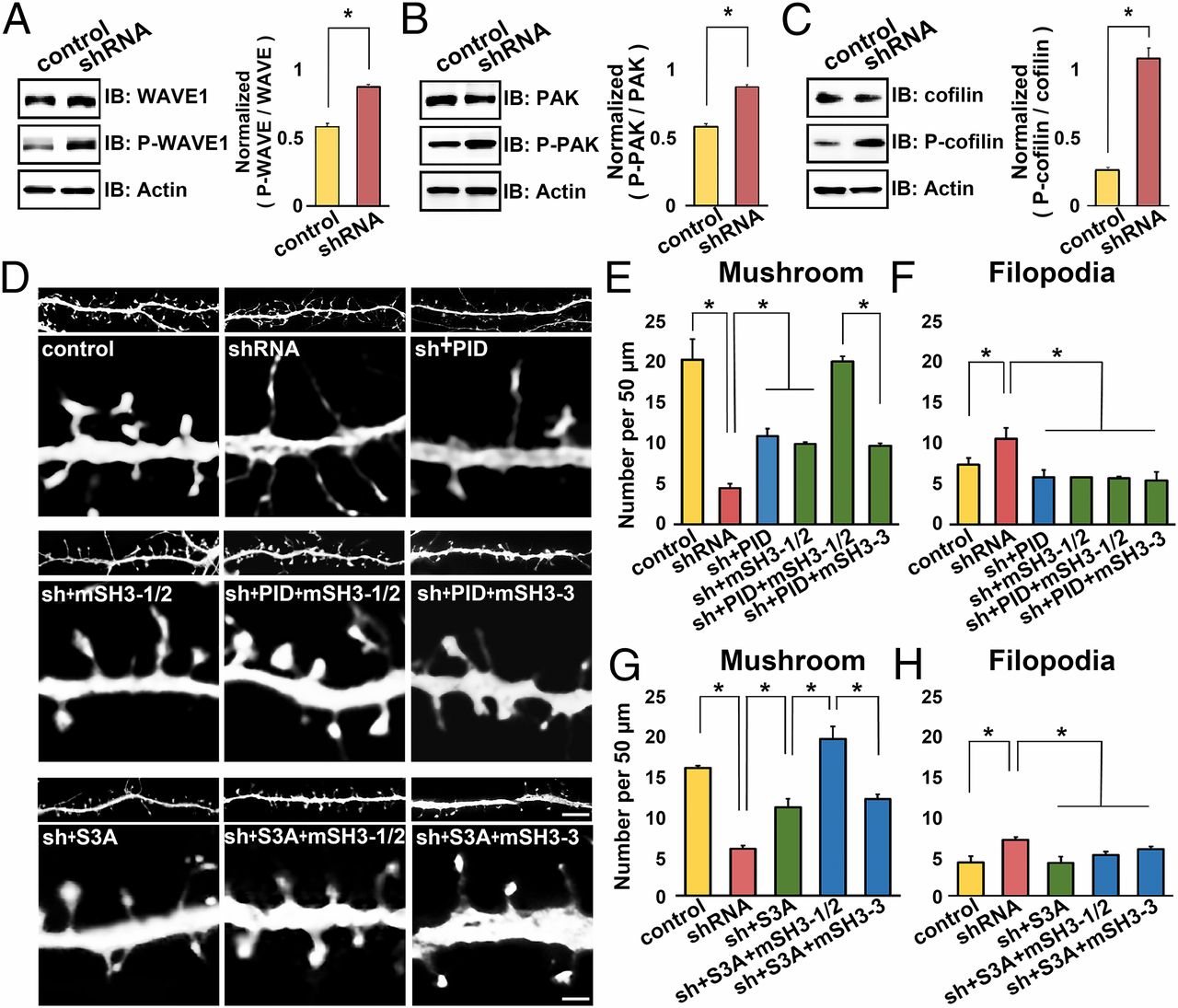
Immunoblotting을 통해 nArgBP2가 KD된 Neuron에서 WAVE/PAK/Cofilin의 인산화가 증가한 것을 확인하였다 (A-C). 또한 KD된 Neuron에서 보이는 Spine Defect가 WAVE와 상호작용을 막은 상태에서 PAK을 억제하는 PAK-Inhibitory Domain (D-F) 또는 Active-Cofilin Mutant를 발현시켰을 경우 Control과 같이 회복되는 것을 확인하였다 (D, G-H).
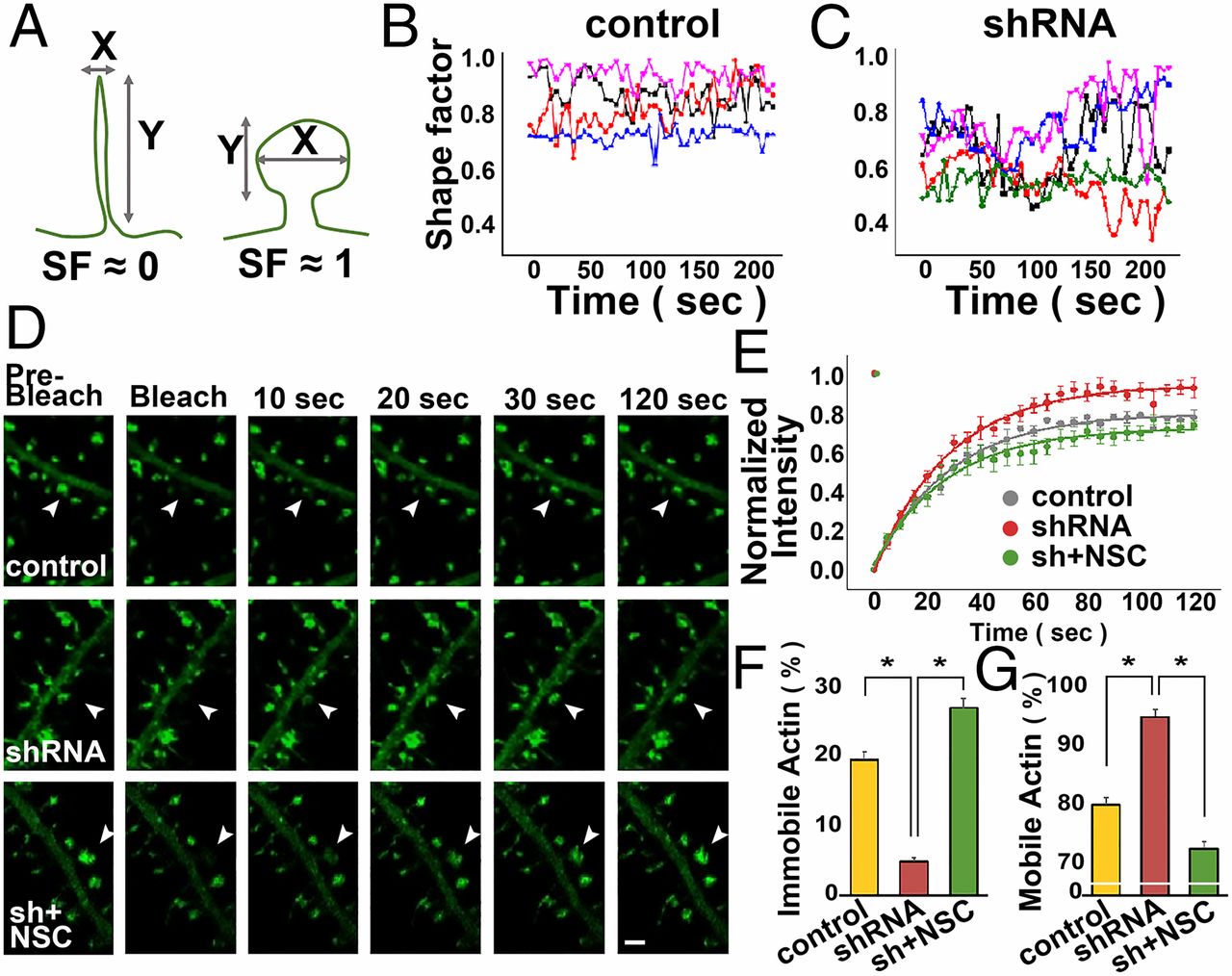
Shape Factor(SF)는 가로길이와 세로길이의 비율로 나타내며, 1에 가까울수록 원형에 가깝고, 0에 가까울수록 긴 형태를 나타낸다 (A). SF의 변동(Fluctuation)은 Spine의 운동성를 나타낸다. Control Neuron과 비교했을 때, KD Neuron의 Shape Factor는 0.5 근처에서 급격하게 변화했다 (B-C). Control과 KD, 그리고 KD에 NSC(Rac1 Inhibitor)를 처리한 Neuron에서 FRAP 실험을 진행한 결과 (A-D), KD Neuron의 Spine에서 Mobile Actin의 비율이 유의하게 증가하였고, NSC 처리군에서는 다시 Control 수준으로 회복되었다 (B-D).
2. Kioka, N., Ueda, K., Amachi, T. (2002) Vinexin, CAP/ponsin, ArgBP2: A novel adaptor protein family regulating
cytoskeletal organization and signal transduction. Cell Struct Funct 27(1):1–7.
3. Hajek, T., Carrey, N., Alda, M. (2005) Neuroanatomical abnormalities as risk factors for bipolar disorder.
Bipolar Disord 7(5):393–403.
4. Cestra, G., Toomre, D., Chang, S., De Camilli, P. (2005) The Abl/Arg substrate ArgBP2/nArgBP2 coordinates
the function of multiple regulatory mechanisms converging on the actin cytoskeleton.
Proc Natl Acad Sci U S A. 102(5):1731–1736.
5. Zhang, Q., et al. (2016) Impaired dendritic development and memory in Sorbs2 knockout mice.
J Neurosci 36(7):2247–2260.
6. Feng, G. (2010) US Patent 20100077493 A1.
7. Han, K., et al. (2013) SHANK3 overexpression causes manic-like behaviour with unique pharmacogenetic properties.
Nature 503(7474):72–77.
8. Peça, J., et al. (2011) Shank3 mutant mice display autistic-like behaviours and striatal dysfunction.
Nature 472(7344):437–442
첨부파일