
생화학분자생물학회입니다.
Hippo Pathway의 전사조절인자 TEAD가 p38 MAPK에 의해 조절되는 새로운 암 억제기전 연구
작성자
관리자작성일자
2018-01-01조회수
1217Hippo Pathway의 전사조절인자 TEAD가 p38 MAPK에 의해 조절되는 새로운 암 억제기전 연구
Regulation of Hippo Pathway Transcription Factor TEAD by p38 MAPK-induced Cytoplasmic Translocation
Nat Cell Biol 19:996-1002, 2017

박현우
연세대학교 생화학과
hwp003@yonsei.ac.kr
연구배경
암은 전 세계 사망원인 1위이며 대부분의 환자는 암 전이 및 항암약물저항성으로 인해 사망한다. 따라서 예전에는 암 발생의 원인 규명이 주로 연구되었다면, 현재는 암 전이 및 약물저항성에 관한 기전 연구가 활발히 진행되고 있다. Hippo Pathway는 10년 전에 Drosophila 및 Mouse의 조직 크기를 조절하는 신호전달 체계로 밝혀진 이후, 최근에 Mammalian Cell에서 강력한 Tumor Suppressor로서 대두되기 시작하였다. Hippo Pathway는 MST1/2-LATS1/2의 Kinase Cascade로 이루어져 있으며 Oncogene인 YAP/TAZ Transcriptional Coactivator를 인산화시킴으로서 억제하고 있다. Hippo Pathway가 억제되면 YAP/TAZ는 활성화되어 TEAD 전사조절인자와 결합함으로써 세포주기 및 성장, 줄기세포 및 재생의학을 비롯하여 다양한 암종의 발생, 전이, 약물저항성 및 재발에 중요한 역할을 담당하고 있다. 현재까지 연구의 대부분이 YAP/TAZ의 역할 및 상위 조절자 규명에 집중되어 있는 반면, Hippo Pathway의 핵심 기능을 수행하는 TEAD 전사조절인자의 조절 기전에 대한 연구는 전무한 실정이었다.
본 연구에서는 최초로 TEAD 전사조절인자의 상위 신호전달 체계를 규명하고자 다양한 분자세포생물학적 실험 기법을 활용하여 암세포 및 마우스 Xenograft 모델에서 연구를 수행하였다. 또한 이를 통해 신규 항암약물 타깃을 규명하고자 하였다.
연구결과
1. p38 MAPK에 의한 TEAD의 세포질 이동 규명
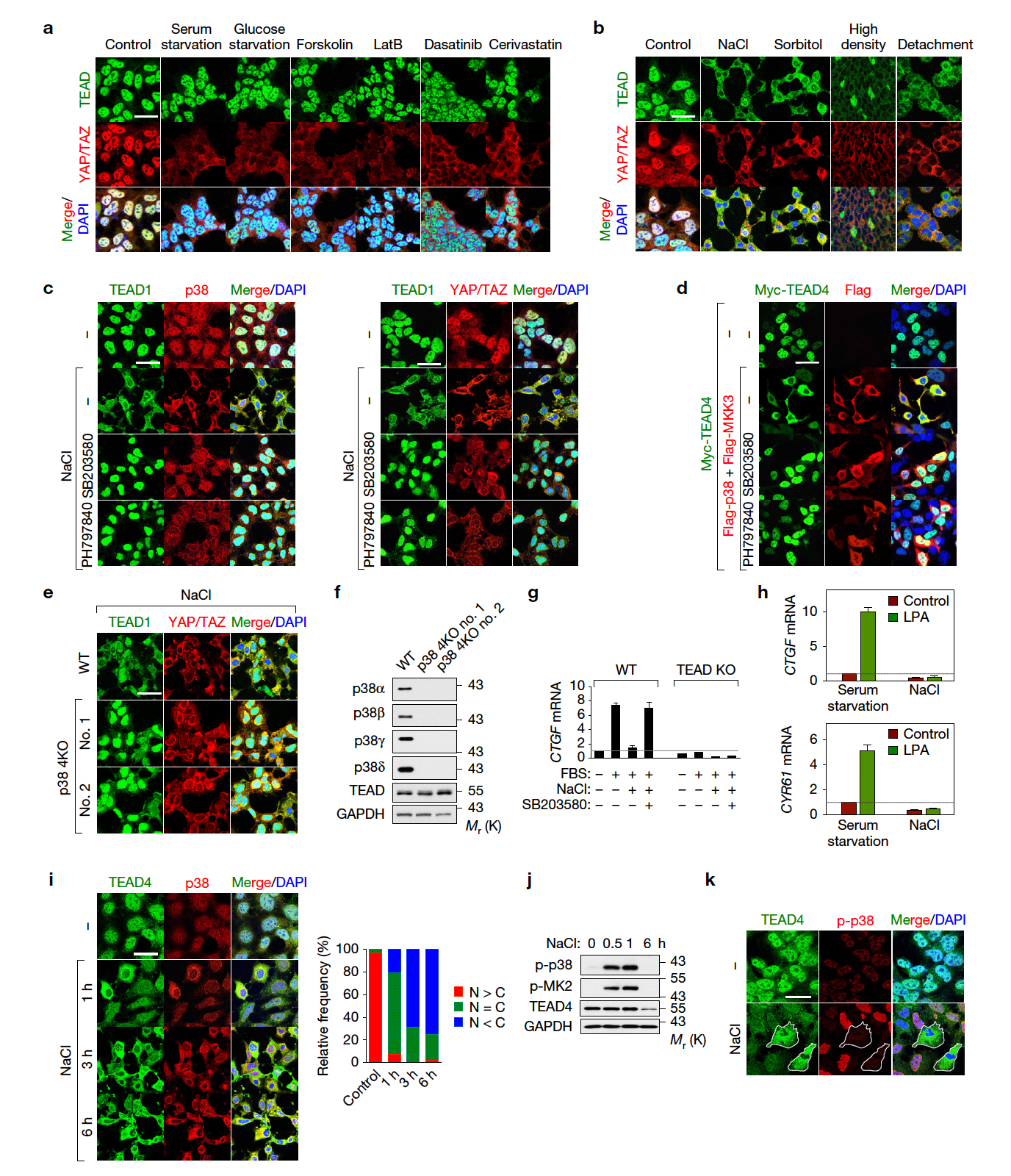
현재까지 연구 결과 TEAD는 항상 세포 핵 내에 위치하고 있다. TEAD가 세포질로 이동하는 조건을 탐색하기 위해 세포 성장을 억제하는 다양한 생리적 조건 (Serum starvation, Glucose Starvation) 및 Cytotoxic 및 FDA-Approved Drug를 세포에 처리한 결과 YAP/TAZ는 세포질로 이동하여 활성이 억제됨을 확인한 반면, TEAD는 항상 핵 안에 위치함을 확인하였다 (a). 하지만, 놀랍게도 특정 환경적인 스트레스(Osmotic Stress, High Cell Density, Cell Suspension)를 세포에 가한 결과 TEAD가 세포질로 이동하는 것을 관찰하였다 (b). TEAD의 Cytoplasmic Translocation은 Stress Kinase인 p38 MAPK에 의해 매개됨을 p38 Inhibitor 및 CRISPR Knockout (KO) Cell을 통해 확인하였다 (c-f). YAP/TAZ 활성은 TEAD의 세포질 이동을 통해 억제되며 이는 환경적 스트레스에 적응하는 기작임을 밝혔다 (g-k).
| |
2. TEAD의 세포질 이동은 p38 MAPK와 단백질 결합을 통해 일어남
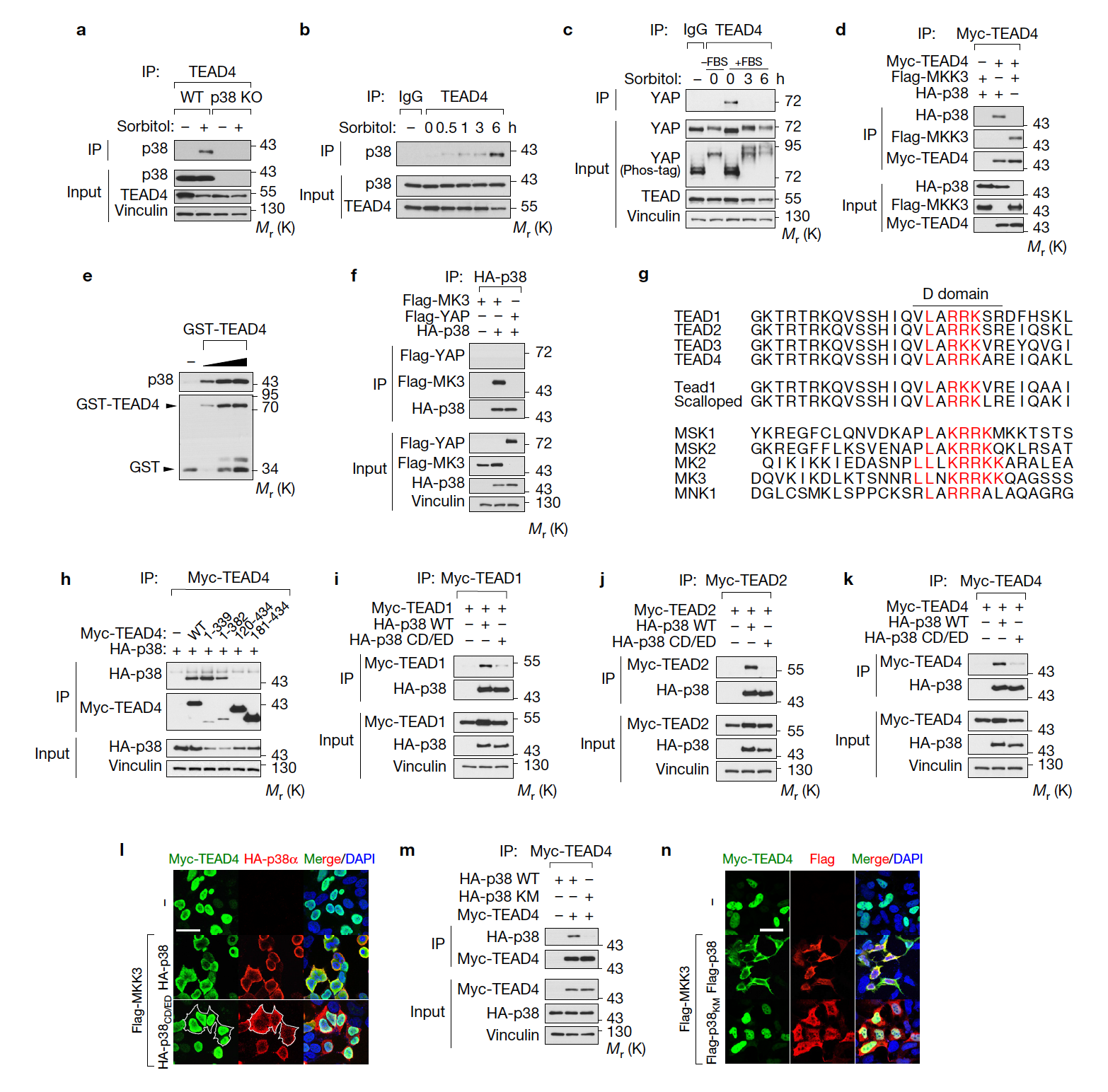
TEAD 세포질 이동의 분자기전을 규명하기 위해 p38의 Kinase Activity 및 Protein-Protein Interaction을 살펴본 결과, p38 Kinase Activity를 통해 TEAD-p38 Complex를 형성함으로써 TEAD의 세포질 이동 및 활성 억제가 일어남을 규명하였다. Osmotic Stress에 의해 YAP-TEAD의 결합은 p38-TEAD 단백질 결합으로 대체되었고, 이는 TEAD Sequence 내에 존재하는 p38-Binding Motif을 통해 이루어진다 (a-h). p38-Binding Motif를 지닌 단백질과 결합을 하지 못하는 p38 Mutant(p38-CD/ED)는 TEAD와의 결합 및 세포질 이동을 유발하지 못함을 규명하였다 (i-n). 따라서, p38과 TEAD 전사조절인자 간의 상호 결합이 TEAD 세포질 이동에 중요하다.
3. TEAD의 세포질 이동을 통한 YAP의 활성 억제 기전 규명
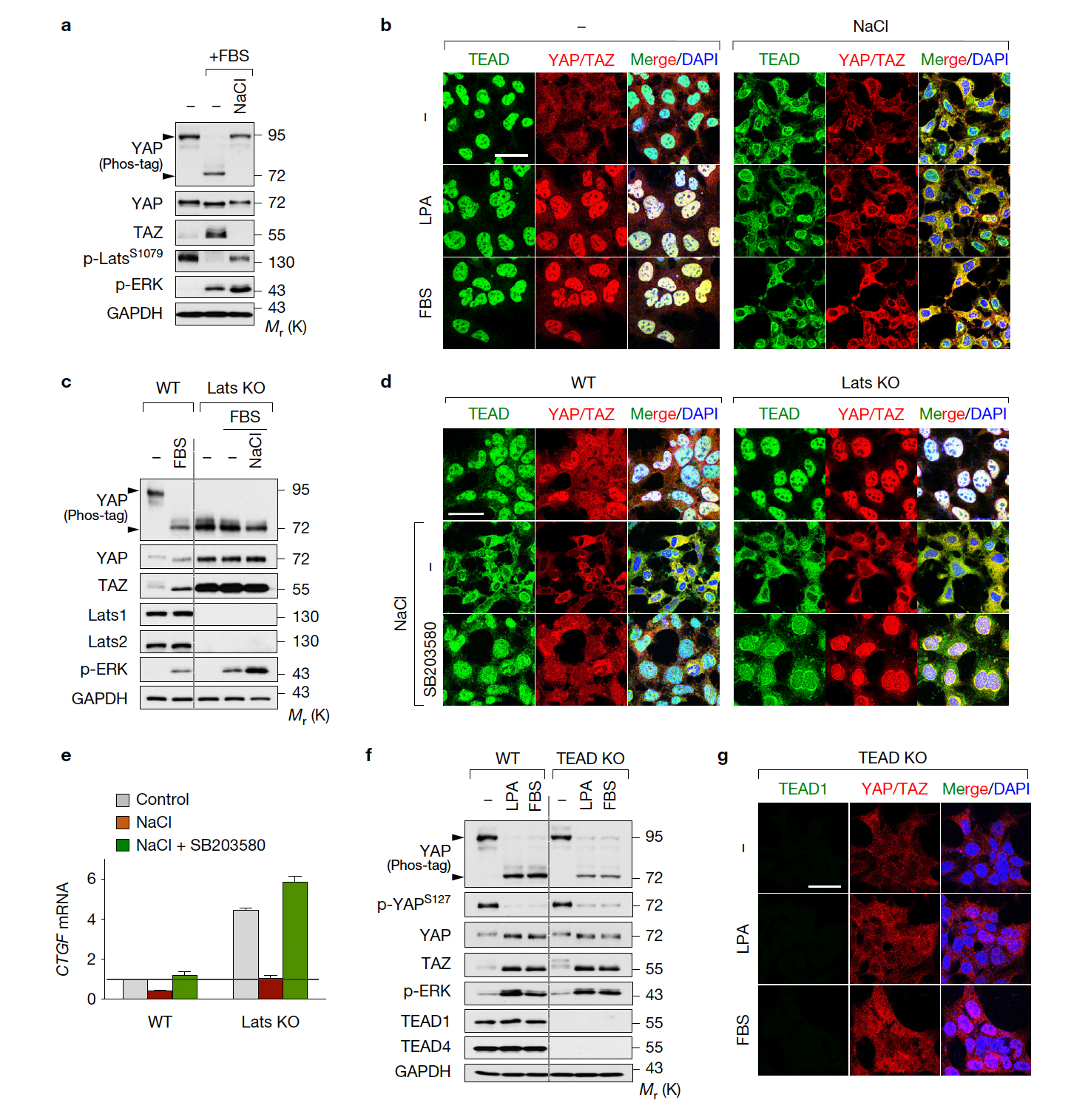
TEAD의 세포질 이동과 Hippo-YAP Pathway와의 연관성을 확인하고자 하였다. TEAD 및 YAP/TAZ는 Osmotic Stress에 의해 동시에 핵에서 세포질로 격리된다 (a, b). TEAD 및 YAP/TAZ가 Hippo Pathway-Dependent한 기전을 통해 세포질로 이동하는지 알아보기 위해 LATS1/2 Double Knockout(DKO) 세포주를 구축하였다. LATS DKO 세포 또한 Osmotic Stress에 의해 TEAD는 세포질로 격리됨을 통해, TEAD 세포질 이동은 Hippo-Independent한 기전임을 밝혔다. 놀랍게도 LATS DKO로 인해 Constitutively 활성화된 YAP/TAZ 또한 핵 내 TEAD가 부재인 상황에서 세포질로 이동한다. 이것은 TEAD가 세포질로 이동하는 상황에서는 YAP/TAZ는 활성화된 상태에서도 핵 내에 존재할 수 없고 타깃 유전자를 전사할 수 없음을 의미한다. LATS1/2 DKO 세포에서 TEAD 및 YAP/TAZ의 세포질 이동은 p38 Inhibitor에 의해 억제된다 (c-e). TEAD의 세포질 이동이 YAP/TAZ의 세포질 이동의 원인임을 규명하기 위해 TEAD1/3/4 KO 세포주를 구축한 결과, TEAD KO 세포에서는 어떠한 자극에 의해서도 YAP/TAZ가 항상 세포질에 존재함을 확인하였다. 이를 통해 TEAD 세포질 이동을 유발하면 YAP/TAZ 활성을 차단할 수 있음을 의미한다.
4. TEAD 활성 억제를 통한 YAP-dependent 암세포 사멸 연구
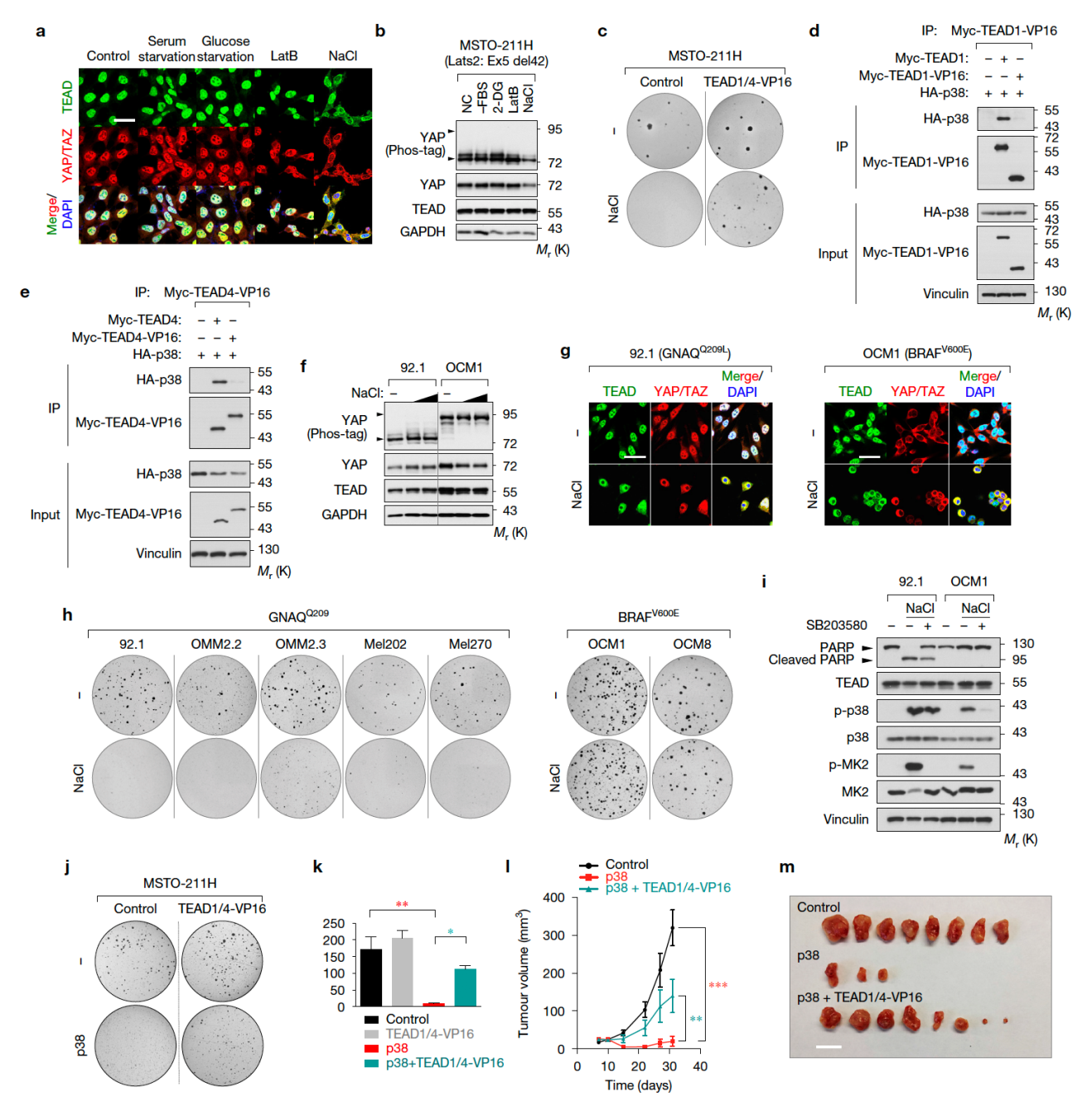
p38에 의한 TEAD 세포질 이동이 YAP/TAZ 활성을 총체적으로 억제하는 기전을 통해 실제 Hippo Mutant 암세포의 성장을 p38-TEAD 조절 기전으로 차단할 수 있는지 연구하였다. 211H Mesothelioma 암세포주는 LATS2 Mutant로 인해 YAP/TAZ와 TEAD는 항상 핵 안에 존재한다. 하지만 Osmotic Stress에 의해 TEAD 및 YAP/TAZ가 세포질로 이동할 수 있으며 Soft Agar Colony Formation 또한 현저하게 감소하여 TEAD 활성 억제가 YAP-Dependent 암세포주의 성장을 저해함을 보였다. 이러한 현상은 Constitutively Active TEAD 과발현을 통해 Rescue된다 (a-e). 이것은 YAP-Driven 암세포주와 다르게 YAP-Independent, BRAF-Driven 암세포주들은 TEAD 억제에 의한 암 억제 효과가 전혀 없는 것으로 보아 Oncogenic Driver 특이적인 현상이다 (f-i). 또한 마우스 Xenograft 모델을 통해서 p38을 과발현시킨 결과 TEAD 억제를 통해 YAP-Driven 암조직의 성장을 현저하게 감소시킨다 (j-k).
연구의 성과 및 의의
.png)
Hippo Pathway는 Tumorigenesis, Stem Cell, Regeneration 관련하여 최근에 각광받고 있는 신호전달 체계이다. TEAD는 강력한 발암유전자로, 암세포증식과 관련 유전자들을 전사시켜 암줄기세포의 발생, 전이, 약물저항성을 일으킨다. 그러나 지금까지 암과 줄기세포에 관한 대부분의 연구는 TEAD의 상위 신호전달 체계인 Hippo-YAP에 의한 간접적인 조절 기전에 집중되어 있었다.
본 연구결과는 세포의 핵 내에 위치한 TEAD가 특정 환경적인 스트레스 상황에서 핵 밖의 세포질로 고립되는 흥미로운 현상을 관찰하고 연구에 착수하게 되었다. 그 결과 TEAD의 세포질 이동은 Hippo-YAP과 무관하게 이루어지며 대신 세포 스트레스 신호에 의해 활성화되는 p38 MAPK 단백질과의 결합을 통해 진행된다는 것이 밝혀졌다. 특히 p38에 의한 TEAD 억제 조절 기전은 기존에 보고된 Hippo-YAP에 의한 TEAD 활성화 기전 및 암세포 증식을 전면 무력화시킬 수 있음을 암세포 및 동물 모델에서 증명하였다. 본 연구결과에 이어 TEAD의 세포질 이동을 유발하는 추가적인 신호전달 체계 및 저분자화합물을 발굴할 계획이다.
참고문헌
1. Yu, F. X., Zhao, B., Guan, K. L. (2015) Hippo Pathway in Organ Size Control, Tissue Homeostasis, and Cancer. Cell 163, 811-828.
2. Park, H. W., Guan, K. L. (2013) Regulationof the Hippo pathway and implications for anticancer drug development. Trends in pharmacological sciences 34, 581-589.
3. Lin, K. C., Moroishi, T., Meng, Z. P., Jeong, H. S., Plouffe, S. W., Sekido, Y., Han, J. H., Park, H. W., Guan, K. L. (2017) Regulation of Hippopathway transcription factor TEAD by p38 MAPK-induced cytoplasmictranslocation. Nature cell biology 19, 996-1002.
4. Lin, K. C., Park, H. W., Guan, K. L. (2017) Regulation of the Hippo Pathway Transcription Factor TEAD. Trends Biochem Sci 17, 30170-6.
첨부파일