일탄소 대사
연구실
(Laboratory of One-Carbon Metabolism)
하은영
계명대학교 의과대학
eyha@dsmc.or.kr
대사(Metabolism)은 세포 혹은 생명체의 생명을
유지하기 위해 일어나는 모든 화학 작용을 말한다. 대사 작용을 통해 ① 에너지원인 ATP 생성 ② 단백, 지질, 당, 핵산 생성 그리고 ③ 질소 배출을 하게 된다. 대사 작용은 생명체가 자라고 환경에 적응하면서 후손을 생성하는 모든 생명
현상에 필수적이다. 하나의 chemical이 일련의 작용들에
의해 다른 chemical로 전환되는 화학 작용들을 metabolic
pathways라고 하며 잘 알려진 예로 해당과정(Glycolysis), tricarboxylic
acid (TCA) cycle, oxidative phosphorylation 등이 있다.
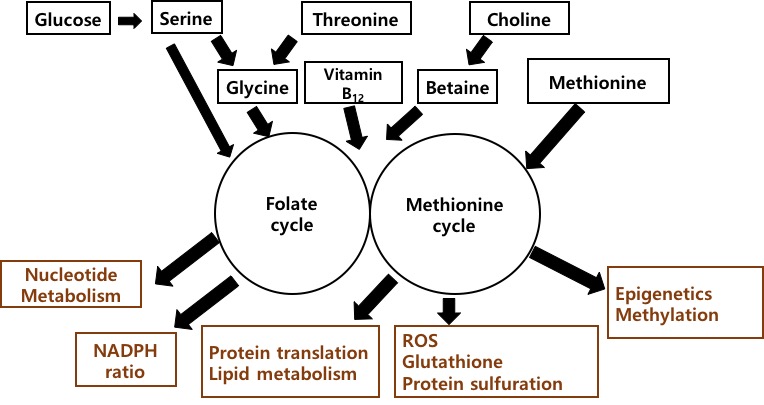
일탄소 대사(One-Carbon Metabolism)는 엽산(Folate)과 메티오닌(Methionine) 대사과정을 주축으로 체외 환경(예, Nutritional Status)을 체내 아미노산 대사, DNA 합성, 활성산소(ROS), 후성유전학 (Epigenetics) 과정으로 연결해주는 complex metabolic
network이다(그림 1& 2). 일탄소 대사는 세포
성장에 필요한 물질들을 생성하는 생합성 대사과정으로 오랜 동안 알려졌기 때문에 해당과정 등과 같이 ‘housekeeping’
과정으로 여겨져 왔다. 하지만 최근 활발하게 발표된 연구 결과로 비 알코올성 지방간, 비만, 당뇨병 등과 같은 대사질환뿐만 아니라 암 발생에도 관여한다는
것이 밝혀졌으며 다른 질병과의 관련성이 계속 밝혀지고 있다(1-3).
그림 1
엽산(Folate)과 메티오닌(Methionine) 대사과정은 서로 독립적으로 존재하지만 비타민 B12를 통해 homocysteine이 메티오닌(Methionine)으로 변환되는 과정을 서로 공유한다 (그림 2). 일탄소 대사(One-Carbon Metabolism)는 메틸기를 제공하는
과정인 transmethylation pathway와 glutathione(GSH)을 생성하는 transsulfuration pathway로 이루어지며 일탄소 대사(One-Carbon Metabolism)의 메틸기 탄소는 아미노산 세린(Serine)과
글라이신(Glycine)으로부터 제공받는다. 포도당(Glucose),
serine, threonine, choline, glycine등은 우리가 먹는 음식으로부터 제공받게 된다. 이러한 input이 일탄소 대사 과정을 거쳐 핵산 생합성, ROS 관련 조효소인 NADPH 생성, 메틸화에 필요한 S-adenosylmethionine(SAM) 생성, 인지질 생합성 등의 output으로 나타나게 된다. 또한 외부 환경으로부터의 input이 일탄소 대사과정 물질인 SAM(S-adenosylmethionine)으로부터 메틸기를 제공받아 DNA,
효소, 혹은 염색체 단백질인 히스톤 등의 메틸화(Methylation)를
통해 조절 기능을 한다. 그러므로 일탄소 대사는 환경과 우리 몸을 연결하는 중요한 고리 역할을 한다는
것을 알 수 있다.
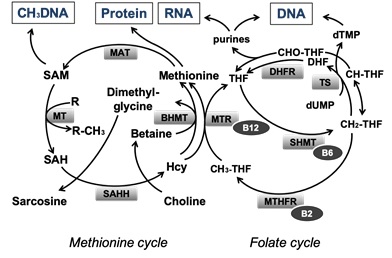
그림 2
일탄소 대사(One-Carbon Metabolism)는 간에서 많이 일어나지만 모든 세포에서 일어나는
대사과정이다. 간에서의 일탄소 대사 과정 특히 methionine
cycle은 비알코올성 지방간(Non-Alcoholic Fatty Liver Disease,
NAFLD) 발생과 밀접하게 관련이 있다는 연구 결과가 계속해서 발표되고 있으며 엽산(Folate)
cycle과 관련된 일탄소 대사 과정은 암 발생과 진행에 관련 있다는 연구 결과가 나오고 있다(4,
5).
본 연구실은
대사 과정 중 비교적 많이 알려져 있지 않은 일탄소 대사(One-Carbon Metabolism)과정이 질병, 특히 비만 관련 질환과 암 발생 및
전이에 미치는 영향, 그리고 그 기전을 밝히는 연구를 다양한 방법을 통해 진행해 오고 있다.
비만대사수술의 일탄소
대사(One-Carbon Metabolism)과정 조절을 통한 대사개선 효과
○ 위우회술(Gastric Bypass)은 그림2와 같이
① 위 면적을 줄이고 ② 음식물이 십이지장과 소장 윗부분(Proximal Jejunum)을 우회하여 소장 중간부분(Middle Jejunum)으로 통과하도록 하는 수술로 음식물이 통과하는 roux limb과 췌장, 쓸개에서
생성된 소화액이 통과하는 biliopancreatic limb, 그리고 이 두 limb이 만나는 common channel이 생성된다 (그림 3).
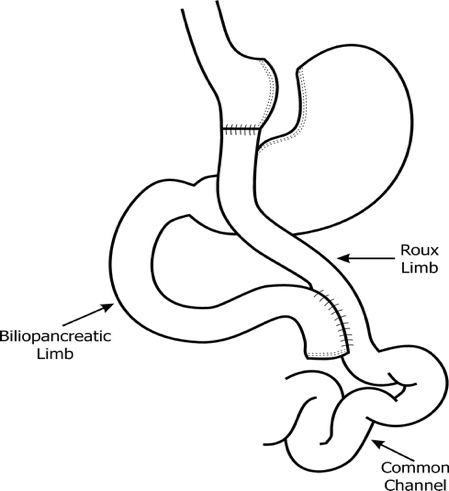
그림 3
비만수술(Bariatric Surgery)은 위우회술을 기반으로
하는 수술로 최초 비만 환자의 체중 감소를 위한 목적으로 시행되었다.
1995년 Pories et al. 이 Annals
of Surgery에 “Who
Would Have Thought It? An Operation Proves to Be the Most Effective Therapy for
Adult-Onset Diabetes Mellitus"라는 제목의 연구결과를 발표하여 위우회술이 비만과 당뇨병 치료에
탁월한 효과(당뇨병 환자 80-90%가 수술 후 혈당 정상화 유지, 기존 투약과 인슐린 주사 중지)를 보인다는 것을 입증하여 현재 전 세계적으로 비만뿐 아니라 당뇨 치료 목적으로 대중화된
수술 치료법이 되었다 (6). 비만은 제2형 당뇨병의 중요한 원인으로 잘 알려져 있으며 일단 당뇨병이 발생하게 되면 약물치료와 같은 일반적인 치료로는 당뇨 합병증 예방 및 실제적인 완치의 효과를 보기는
어렵다 (7). 최근 비만 환자에서 당뇨병의 예방과 치료를 위한 관점에서 비만 수술이 효과적이라는 연구 결과와 임상 결과가 계속 보고되고 있으며 (8) 미국에서는 1992년 NIH Consensus
Conference에서 비만 치료를 위한 수술적 방법이 인정되었고 세계
당뇨병 연합에서도 당뇨치료법으로 공식적으로 발표하였다.
이러한
임상 결과에 따라 비만 수술이라는 용어는 현재 대사수술(Metabolic Surgery)로 대체되었으며 수술 효과를
나타내는 임상 연구 결과가 폭발적으로 늘어났다. 우리 나라도 금년 1월 1일부터 ▲체질량지수(BMI)
35kg/m² 이상인 경우 ▲체질량지수 30kg/m² 이상이면서 고혈압, 당뇨, 고지혈증, 수면무호흡증, 관절질환, 비 알코올성 지방간, 위식도역류증, 천식, 심혈관질환(심근병증, 관상동맥질환), 성난소증후군 등 비만 관련 합병증이 있는 경우 ▲내과적
치료에도 혈당조절이 되지 않는 체질량 지수가 27.5kg/m²이상인 제2형 당뇨 환자인 경우 대사수술 건강보험을 적용 받을 수 있게 되어 환자들의 경제적 부담이 줄어들게 되었다. 현재 시행되고 있는 대사수술의 종류에는 ① 루와이위우회술(Roux-en-Y Gastric Bypass, RYGB) ② 위소매절제술(Sleeve Gastrectomy,
SG) ③ 십이지장소장우회술(Duodenal-Jejunal
Bypass (DJB) ④ 위밴드술(Adjustable Gastric Banding)등이 있으며 루와이위우회술과 위소매절제술을 가장 많이 시행하고 있다.
수많은 임상 결과에
의해 비만대사수술의 효과는 확고하게 입증되었지만 기술적 문제로 인한 동물 연구의 어려움과 인간을 대상으로 한 임상 연구의 한계성등으로 인해 정확한
기전은 아직 밝혀지지 않고 있다.
본
연구실에서는 2012년부터 일반외과 전문의 선생님과의 공동 연구를 통해 약 1년 여에 걸쳐 쥐 대사수술 모델을 확립하였다. 2013년 쥐 비만대사수술
모델 (그림 4) 간에서 메타볼롬(Metabolome) 분석과 분자생물학적 방법을 이용하여 비만대사수술이 일탄소 대사 과정, 특히 trans-sulfuration 과정과 purine 대사 과정을 변화시켜 에너지 생성 증가와 지방산 산화(Fatty Acid
Oxidation) catabolic pathway를 활성화시킨다는 결과를 얻었다 (그림
5).
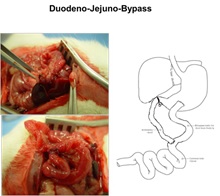
그림 4
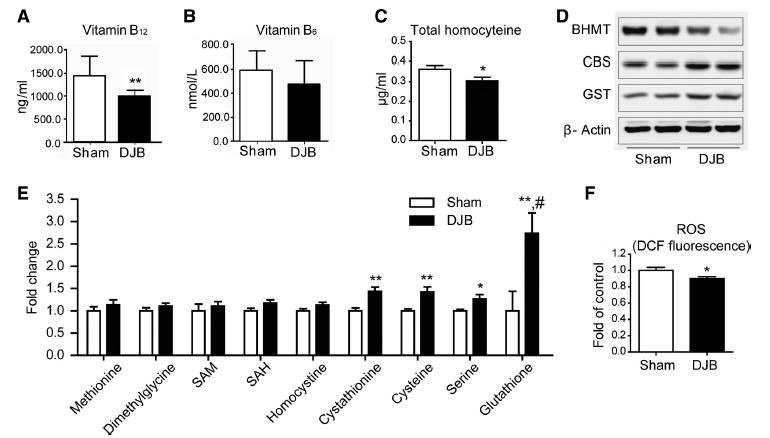
그림 5
비만대사수술군과 대조군과의 대사체, 단백체 패턴 차이를 확인하였고 분석 결과 일탄소 대사 과정에 관여하는 물질과 효소인 formate, Vitamin B12, B6,
glutathione, aldehyde dehydrogenase, betain homocysteine methyl transferase(BHMT),
cystathione-beta transferase(CBS), glutathione-S transferase(GST)의 농도와 발현이 변화하여 일탄소 대사 과정의 metabolic shift가 발생하였음을 확인하였다. 또한 엽산(Folate) 대사 과정을 통해 연결된 염기 합성 증가와 염기 합성에 필요한 전구체인 오탄당 합성이 증가한다는 것을
간접적으로 증명하였다 (9).
당뇨병 치료는 약물치료와 더불어 식이요법, 운동과 같은 생활습관 변화(Life Style
Modification)가 필수적이다. 하지만 대부분의 당뇨병 연구는 약물치료를 위한 신약개발에 초점을 두고 있는 실정이다. 당뇨병은 단순히 인슐린 분비 저하로 인한 질병이 아닌 내분비계 질환으로
신체 내 여러 장기(간, 뇌, 장, 근육, 지방, 췌장)가 서로 밀접하게 연관되어 있어 기존의 치료약물 개발을 목표로 하는 연구로는 한계가 있다.
환경 자극(Stimuli)에 반응한 후성유전학적 변화(Epigenetic
Changes)가 당뇨병 발생에 중요한
역할을 할 것이라는 연구결과가 최근 발표되고 있다. 동일한 유전정보를 가진 쌍둥이라도 환경에 따라 당뇨병 발생이 틀리다는 사실은 이미 잘 알려져 있다.
본 연구실에서는 기존 예비 연구 결과를 바탕으로 대사수술에 의한 해부학적 구조변화에 의해 영양소 대사가 변화하여 기능을 조절한다는 연구
가정(그림 6)을 세웠다.
그리고 이 연구 가정을 바탕으로 대사수술이 일탄소 대사, 특히 메틸화(Methylation)에 의한 후생유전학(Epigenetics) 변화를
확인하는 연구를 진행하고 있다. 또한 (생)쥐 대사수술 모델을 이용한 연구 결과가 인간에게도 적용 가능한지 확인하기 위해 Korean OBEsity Surgical Treatment Study (KOBESS)를 통해 수집된 대사수술
환자 조직 샘플을 병행하여 분석하고 있다. 이 연구로 인해 환경에 따른 후성유전학적 변화가 당뇨병 발생과
치료에 어떤 역할을 하는가를 규명할 수 있는 결과를 얻을 수 있을 것이라 생각한다.
그림 6
위에서 언급한 바와 같이 일탄소 대사과정은
엽산(Folate)과 메티오닌(Methionine) 대사과정을 주축으로 아미노산, 포도당(Glucose), 비타민과 같은 영양소(Input)를 체내 지질, 단백, DNA 합성, 활성산소(ROS) 대사 과정으로 연결해주는 중요한 대사과정이다. 최근 대사 물질에 의한 유전자 조절 작용이 대두되고 있으나 관련 연구는 아직 초기단계이다. 본 연구실에서는 대사수술 쥐모델을 이용하여 얻은 결과를 바탕으로 대사수술 동물 모델을 통한 대사수술 효과 기전을 밝히는 연구를 통해 덜
침습적(Less Invasive)이고 접근성이 용이한(More Accessible)
치료법 개발을 목표로 연구를 진행하고 있다.
References
1. Ducker GS,
Rabinowitz JD. One-Carbon Metabolism in Health and Disease. Cell Metab 2017;25(1):27-42.
2. Locasale JW. Serine,
glycine and one-carbon units: cancer metabolism in full circle.
Nat Rev Cancer 2013;13(8):572-83.
3. Walker AK. 1-Carbon
Cycle Metabolites Methylate Their Way to Fatty Liver.
Trends Endocrinol Metab 2017;28(1):63-72.
4. Trimble KC, Molloy
AM, Scott JM, et al. The effect of ethanol on one-carbon metabolism: increased
methionine catabolism and lipotrope methyl-group wastage. Hepatology 1993;18(4):984-9.
5. Michelotti GA,
Machado MV, Diehl AM. NAFLD, NASH and liver cancer.
Nat Rev Gastroenterol Hepatol 2013;10(11):656-65.
6. Pories WJ, Swanson
MS, MacDonald KG, et al. Who would have thought it? An operation proves to be
the most
effective therapy for adult-onset diabetes mellitus. Ann Surg 1995;222(3):339-50
7. Kahn SE, Hull RL,
Utzschneider KM. Mechanisms linking obesity to insulin resistance and type 2
diabetes.
Nature 2006;14(444):840-46.
8. Schauer PR, Bhatt
DL, Kirwan JP, et al. Bariatric Surgery versus Intensive Medical Therapy for
Diabetes
- 5-Year Outcomes. N Engl J Med 2017;16(376):641-51.
9. Jung J, Ha TK, Lee
J, et al. Changes in one-carbon metabolism after duodenal-jejunal bypass
surgery.
Am J Physiol Endocrinol Metab 2016;310(8):E624-E32.

.jpg)