
생화학분자생물학회입니다.
세포 주기와 만능줄기세포 (Cell Cycle in Pluripotent Stem Cell)
작성자
관리자작성일자
2019-08-01조회수
1480세포 주기와 만능줄기세포
(Cell Cycle in Pluripotent Stem Cell)

장지원
포항공과대학교 생명과학과
jiwonjang@postech.ac.kr
서론
PSC (Pluripotent Stem Cell, 만능줄기세포)를
정의하는 두 가지 특징은 자가재생산 (Self-Renewal)과 만능분화능 (Pluripotency)이다. 일반적으로 제한된 분열 횟수를 가지는
분화된 세포와는 달리 PSC는 특정 배양조건에서 끊임없이 분열할 수 있다 (Long-Term Self-Renewal Ability). 또한 적절한 분화 조건에서 우리 몸을 구성하는 모든
종류의 체세포로 분화할 수 있는 능력을 가지고 있다 (Pluripotent Differentiation Potential).
PSC에는 크게 세 종류의 세포가 포함된다. 첫번째는 teratocarcinoma라고
불리는 암에서 분리된 Embryonic Carcinoma (EC) 세포이다. Teratocarcinoma는 다양한 배엽에서 유래된 암 조직들을 가지고 있는 것이 특징인데, 이와 일치하게도 EC세포는 in
vitro 배양 조건에서 삼배엽 (외배엽, 중배엽, 내배엽)을 모두 만들어 낼 수 있다 (1). 두 번째는 착상 전 blastocyst의 inner cell mass에서 분리해 낸 ESC (Embryonic Stem Cell, 배아줄기세포)이다. EC세포 배양 기술을 기반하여, 1981년에 mESC (mouse ESC)가 처음으로 보고 되었으며 (2, 3), 1998년에는 hESC
(human ESC)의 추출 및 배양 기술이 보고 되었다 (4). 세 번째는
2006년에 Shinya Yamanaka에 의해 보고된
iPSC (induced PSC, 유도만능줄기세포)이다 (5). 유도만능줄기세포는 fibroblast와 같이 완전히 분화된 세포를 4가지 전사인자 (OCT4, SOX2, KLF4, MYC)를 통해 역분화 (Cellular Reprogramming)시켜서
만들어 진다. 이와 유사한 방법에는 체세포핵치환 (Somatic Cell
Nuclear Transfer, SCNT)이 있으며, 핵이 제거된 난자에 체세포의 핵을
삽입함으로써 체세포의 핵을 리프로그래밍 할 수 있다. ESC와 iPSC는
기원이 되는 세포가 완전히 다름에도 불구하고, 매우 유사한 특징 및 기능을 보인다. PSC는 세포 분화 및 발생 과정을 이해하는데 훌륭한 실험 플랫폼을 제공할 뿐만 아니라, 세포 치료제, 약물 스크리닝, 질병
모델링 등에도 활발하게 이용되고 있다. 하지만, PSC가
가지는 자가재생산과 만능분화능의 분자적 메커니즘에 대한 깊은 이해가 없다면, 이 세포를 이용한 응용
연구가 성공적인 치료로 이어질 확률이 낮다.
세포주기 (Cell Cycle)는 세포 분화 및 발생과 밀접하게 관련되어 있다. 초파리와 개구리에서 포유류에 이르기까지 미분화세포 (Uncommitted Cell)가 매우 빠르게 분열하는 것은 초기 발생의 공통된 특징이며, 미분화세포가 분화함에 따라 세포 분열 속도가 느려진다 (6, 7). 또한 세포주기에서 빠져나와서 G0기에 들어가는 것은 최종 분화된 세포 (Terminally Differentiated Cell)에서 많이 관찰되는 현상이다. 따라서 본론에서는 PSC가 보이는 세포주기 상의 특징에 대해서 알아보고, 이것이 자가재생산과 만능분화능에 어떠한 역할을 하는지에 대해 논의해보고자 한다.
본론
2-1. Cell cycle control in mammalian cells
세포주기는 DNA 복제가 일어나는 S기와 두 개의 딸세포로 분열하는 M기가 반복적으로 일어나는 과정이며, S와 M기는 두 개의 gap기인 G1, G2기로 분리되어 있다. 세포주기의 조절은 Cyclin-Dependent Kinase (CDK)라고 불리는 인산화 단백질에 의해 이루어지며, cyclin 단백질과의 결합을 통해 CDK는 활성화 된다 (8). Cyclin 단백질의 발현은 전사 및 전사 후 조절 메커니즘을 통해 세포주기 과정에서 정확하고 세밀하게 조절된다. 세포가 성장인자 (Growth Factor) 신호를 받게 되면, CDK4/cyclin D 복합체가 활성화되고, 이어 CDK2/cyclin E 복합체가 활성화되어서 G1기가 S기로 전환되는 것을 유도한다. Retinoblastoma (RB) 단백질은 E2F 전사인자를 억제하고 있는데, 활성화된 CDK4와 CDK2 복합체는 RB단백질을 인산화하여 분해시킨다. 이를 통해 E2F 전사인자는 탈억제 (Derepression)되고, 핵으로 들어가서 DNA복제에 필요한 다양한 유전자들의 발현을 유도한다. 이 조절 메커니즘은 Restriction (R)-point를 구성하는 핵심이며, 세포는 R-point에서 계속 분열을 할 것인지 아니면 세포주기를 빠져나가 G0기에 들어갈 것인지를 결정하게 된다.
G2기에서 M기로의 전환은 cyclin B 단백질의 축적과 CDK1의 활성화에 의해 이루어 진다. 활성화된 CDK1/cyclin B 복합체는 방추사 (Mitotic Spindle) 형성, 염색체 응축 및 분리 등에 관여하는 많은 단백질들을 인산화하여 mitosis를 조절한다. 또한 CDK1/cyclin B 복합체의 활성이 억제되는 것은 세포가 mitosis를 마치고 G1기로 빠져나오는데 중요한 역할을 한다. 앞서 언급한 다양한 CDK와 cyclin의 복합체 외에도 p21, p27, p16과 같은 CDK 억제 단백질 (CDK Inhibitor)들도 CDK 활성 조절에 관여함으로써 정밀한 세포주기 조절을 돕는다.
2-2. Cell cycle control in PSCs
착상 전 생쥐의 blastocyst에 존재하는 PSC인 epiblast는 매우 빠르게 분열하며, 약 4.4시간의 세포주기를 가진다. 하지만 착상 후 낭배형성 (Gastrulation) 과정으로 들어가게 되면, 세포 주기가 16시간 이상으로 증가한다 (9, 10) (그림 1). 빠른 분열 속도와 일치하게도 생쥐 epiblast는 대부분 S기 (약 60%)에 존재하며, G1과 G2기에 존재하는 세포의 비율이 매우 적다 (11). 짧은 G1기는 분열을 마친 세포가 빨리 S기로 들어가게 함으로써 빠른 분열을 도울 것으로 생각된다. 이와 같은 세포주기의 구조는 상당히 특이하며, 체세포의 세포주기와 구별된다. 체세포의 경우, 세포주기의 대부분을 G1기가 차지하고 있으며, S기에 있는 세포의 수는 매우 적다. In vitro에서 배양되는 mESC도 생쥐 epiblast와 같이 높은 S기 비율을 보이고 있으며 (11), hESC에서도 체세포에 비해 G1기 비율이 낮고, S기 비율이 높은 세포주기 형태가 관찰된다 (12). 그렇기 때문에 PSC 특이적인 세포주기가 PSC의 기능, 즉 자가재생산과 만능분화능에 중요한 역할을 할 것이라고 생각된다.
체세포에서는 cyclin 단백질의 발현이 세포주기 동안 정밀하게 조절되는 반면, mESC에서는 cyclin E와 cyclin A 단백질이 세포 주기와 무관하게 항상 발현된다는 것이 보고 되었다 (11). 그로 인해 CDK2는 항상 활성화되어 있으며 RB단백질은 불활성화 되어있다. 또한 CDK 억제 단백질들도 mESC에서 발현되지 않는다 (11, 13). 이를 통해 mESC에는 R-point가 존재하지 않고, G1기에서 S기로의 전환이 빨리 일어나게 된다. mESC과 hESC은 발생학적으로 서로 다른 PSC를 대표한다. mESC은 naïve PSC로써 착상 전 배아에 존재하는 epiblast와 유사하며, hESC은 primed PSC로써 착상 후 배아의 epiblast와 비슷한 특징을 보인다. 흥미로운 점은 hESC에서는 CDK활성이 세포주기에 의해 조절된다는 것이다. Cyclin 단백질들이 세포주기에 따라 달리 발현되며, CDK 억제 단백질들의 발현도 유도된다. 그렇기 때문에 R-point 없이 빨리 분열하던 naive PSC은 착상 과정에서 R-point를 가지게 되고, 이 과정이 삼배엽 분화에 중요한 역할을 할 것으로 생각된다 (그림 1).
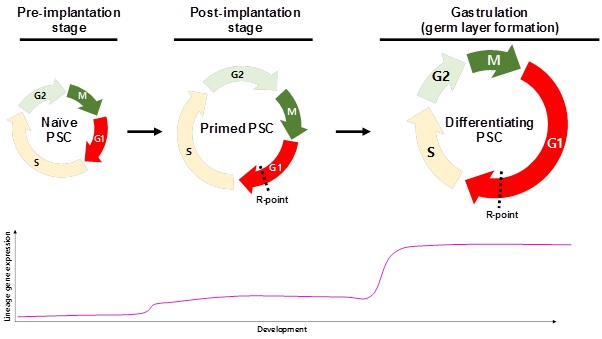
그림1. 발생
과정에서 PSC의 세포주기 변화와 분화 관련 유전자의 발현 양상
짧은 G1기는
PSC의 자가재생산과 분화 억제에 중요한 기능을 수행한다. 왜냐하면, 화학적 CDK 억제제 (Chemical
CDK Inhibitor)를 사용하여 G1기 길이를 임의로 증가시키면, PSC는 자가재생산을 멈추고 분화를 하게 된다 (14,
15). 반대로 S기와 G2기 관련 유전자들은 PSC의 분화를 억제하는 역할을 한다 (16). 세포주기의 중요성은 pluripotency 유전자들이 세포주기 관련 유전자들의 발현을 조절한다는 사실에서 재확인된다. 중요한 pluripotency 단백질인 NANOG는 CDK6, cyclin E, cyclin D, CDC25A 등의
발현을 증가시킴으로써 G1기에서 S기로의 전환을 촉진한다
(17,
18). OCT4 (POU5F1)은 CDK 억제유전자인 p21의 발현을 억제함으로써 G1기 길이를 조절한다 (19). 반대로 세포주기 관련 유전자들이 pluripotency 유전자의 발현 및 활성에 영향을 주기도 한다. 중요한
세포주기 단백질인 GEMININ은
chromatin-remodeling 단백질인 BRG1의 활성을 조절하여, Oct4, Nanog, Sox2의
발현을 억제한다 (20). 또한 CDK2는 SOX2 단백질을 직접 인산화시킨다는 것이 보고되었다 (21). 앞선 예들에서 볼 수 있는 것처럼, 세포주기와 pluripotency는 복잡한 메커니즘을 통해 긴밀히
상호작용한다는 것을 알 수 있다.
2-3. Cell cycle and PSC differentiation
세포는 G1기에 있을 때 외부 자극에 반응하여 자신의 운명을 변화시킬 수 있다. 다시 말해 G1기는 PSC가 pluripotent state를 벗어나 다른 종류의 세포로 분화할 수 있는 기회의 창 (a window of opportunity)인 셈이다. 앞서 언급한 것처럼 PSC는 미분화 상태에서 짧은 G1기를 가지지만, 분화하게 되면 G1기가 길어지면서 pluripotency 유전자들의 발현이 감소하고 삼배엽을 대표하는 분화 마커 (Lineage Marker)들의 발현이 증가하게 된다 (그림 1). 흥미로운 점은 G1기 길이가 길어지는 현상이 배엽 특이적으로 일어난다는 점이다 (22). hESC가 신경외배엽 (Neuroectoderm)으로 분화하는 과정에서는 G1기 길이가 분화 24시간 이내에 길어지는 반면, 중내배엽 (Mesendoderm) 분화 과정에서는 초기 중내배엽 마커들이 모두 발현될 때까지 짧은 G1기를 유지한다. 또한 CDK4/6 억제제를 처리하여 hESC의 G1기 길이를 증가시킨 후 분화를 유도하면 신경외배엽 분화가 촉진되는 반면, 중내배엽 분화는 억제된다 (22). 이 결과는 G1기 길이가 길어지는 것이 단순히 분화하는 PSC에서 나타나는 결과 (Consequence)가 아니며, G1기 길이는 배엽 특이적으로 조절되고, PSC의 분화 운명을 결정하는데 중요한 역할을 한다는 것을 의미한다.
PSC 분화 과정에서 G1기가 길어지는 세포주기의 변화는 CDK활성의 감소와 RB단백질의 활성화에 의해 일어난다 (11, 13). mESC에서 cyclin E를 knockdown하게 되면, G1기 길이가 증가하고 mESC은 분화하며, 반대로 cyclin E를 과발현시키면, mESC의 분화가 억제된다 (23). CDK 억제 단백질도 G1기 길이 조절에 중요한 역할을 한다. P21과 p27은 미분화 상태의 hESC에서 낮은 발현을 유지하지만, 분화 자극을 받게 되면 발현이 크게 증가한다 (24). RB 단백질과 R-point 또한 PSC의 분화에 중요한 역할을 한다. RB를 포함하는 총 세 개의 pocket-protein family 유전자들 (Rb, Rbl1, Rbl2)을 mESC에서 모두 knockout하면 proliferation에는 큰 영향이 없으나, 분화 과정에서 문제가 발생한다는 것이 보고되었다 (25). 이는 RB와 R-point에 의해 조절되는 G1기 길이 변화가 PSC가 pluripotent state를 벗어나 삼배엽으로 분화하는데 필수적이라는 것을 의미한다.
PSC는 G1기에 있을 때 분화 자극에 반응한다는 사실은 오래 전부터 알려져 왔지만, 최근 FUCCI라 불리는 세포주기 리포터 (Cell Cycle Reporter)의 개발로 더 확실한 실험적 증거를 얻게 되었다. FUCCI 리포터는 형광 단백질이 GEMININ과 CDT1 단백질에 fusion된 형태이며, 이를 통해 세포는 G1기에 빨간색 형광을, S/G2/M기에 초록색 형광을 띄게 된다 (26). FUCCI hESC을 이용하여 G1기와 S/G2/M기 세포를 FACS sorting한 후 분화를 유도한 결과, G1기에 있는 hESC만이 분화 자극에 반응한다는 것을 확인하였다 (27). FUCCI hESC을 이용한 다른 논문에서는 삼배엽 마커 유전자들이 G1기에서 발현된다는 것을 보였다 (28). 이 실험적 증거들은 PSC가 G1기에 있을 때 pluripotent state를 벗어날 수 있다는 것을 명확히 보여주며, 세포주기와 분화가 밀접하게 상호 작용한다는 것을 의미한다.
2-4. Molecular mechanisms linking the cell cycle to cell fate decision
앞서 언급한 것처럼 PSC는 G1기에 있을 때 분화할 수 있다. 여기서 더 나아가 FUCCI hESC을 이용한 논문에서는 hESC가 early G1기에 분화 자극을 받게 되면 중내배엽으로 분화하는 반면, late G1기에는 외배엽으로 분화한다는 것을 보였다 (27) (그림 2A). Early/late G1기와 PSC 분화 운명을 연결하는 메커니즘에는 cyclin D가 중요한 역할을 한다 (27). Cyclin D는 G1기 동안 축적되기 때문에, late G1기 세포 내에는 cyclin D 단백질 양이 많고, 그로 인해 CDK4/6가 활성화되어 있다. 활성화된 CDK4/6는 Activin/Nodal 신호전달경로의 중요한 단백질인 SMAD2,3를 인산화시켜서 핵으로의 이동을 막는다. Activin/Nodal 신호전달경로는 외배엽 분화를 억제하고 중내배엽 분화를 촉진하는 역할을 하기 때문에, 이 메커니즘을 통해 late G1기 PSC는 외배엽으로 분화하게 된다. 반대로 early G1기에 있는 PSC는 CDK4/6의 활성이 낮기 때문에, Activin/Nodal 신호전달경로를 통해 중내배엽으로 분화한다. 이 메커니즘과는 독립적으로 cyclin D는 hESC에서 삼배엽 마커 유전자들의 전사조절 부위에 직접 결합하여 발현을 조절한다는 것이 보고되었다 (29). Late G1기에 많이 축적된 cyclin D는 핵으로 이동하여 외배엽 관련 유전자들의 발현을 활성화시키고, 중내배엽 관련 유전자들의 발현은 억제하는 메커니즘을 통해 PSC의 분화 운명을 조절한다.
일차섬모 (Primary Cilium)는 세포의 안테나로써 역할을 하며, 세포주기에 의해 조절된다. 일차섬모는 G1기에 만들어지고, G2기에 흡수되어서 사라지는 과정을 반복한다. hESC이 신경외배엽으로 분화하는 과정에서 G1기가 길어지게 되고, 그로 인해 일차섬모를 가진 세포의 수가 증가한다 (22). 증가된 일차섬모는 오토파지를 활성화시키고, 이를 통해 Nrf2 (NFE2L2) 활성을 억제한다. Nrf2 전사인자는 hESC가 신경외배엽으로 분화하는 것을 억제하는 역할을 하기 때문에, G1기-일차섬모-오토파지 축의 활성화는 hESC가 신경외배엽으로 분화하는 것을 유도하는 중요한 메커니즘으로 작용한다 (그림 2B).
후성유전체 (Epigenetics) 수준의 조절도 세포주기와 PSC 분화를 연결하는 중요한 메커니즘을 제공한다. Genomic DNA의 cytosine은 DNA methyltransferase에 의해 methylation 될 수 있다. 5-methylcytosine (5-mC)은 TET 단백질에 의해 hydroxylation 되어서 5-hydroxymethylcytosine (5-hmC)을 형성한다. 5-hmC는 open chromatin 구조와 전사 활성화와 연관되어 있다. 흥미로운 점은 미분화상태의 PSC에서 삼배엽 분화 관련 유전자들은 프로모터에 높은 수준의 5-hmC를 가지고 있으며, 5-hmC의 축적이 G1기 동안 일어난다는 것이다 (28). 전사 활성화와 관련된 또다른 후성유전체 마커인 H3K4me3도 삼배엽 분화 관련 유전자들의 프로모터에 존재하며 세포주기에 의해 조절된다는 것이 보고되었다 (30). 지금까지의 증거를 종합하면, 세포주기는 Activin/Nodal과 같은 발생에 중요한 신호전달경로, 일차섬모를 통한 신호 전달, 후성유전학적 메커니즘 등을 통해 PSC의 분화 운명을 조절한다 (그림 2C).

그림 2. (A) 세포주기에 따른 PSC의 분화 운명. (B) G1기가 일차섬모-오토파지-Nrf2축을 통해 신경외배엽 분화는 촉진하는 경로. (C) G1기가 PSC의 분화 운명을 조절하는 메커니즘
결론
세포는 매 세포주기마다 외부 및 내부 환경으로부터
오는 신호들을 종합하여 계속 분열할 것인지 아니면 분열을 멈추고 세포주기를 빠져나갈 것인지에 대한 결정을 내린다.
그 결정의 중요한 순간이 G1기에 존재하는 R-point이며, R-point를 넘어서면 세포는 외부 자극에 무관하게 분열을 하게 된다. 흥미로운
점은 단세포 생물이 다세포 생물로 진화하는 과정에서 G1기는 단순히 세포 분열 여부를 결정하는 것을
넘어서 줄기세포의 분화 운명을 결정하는데도 역할을 하게 되었다는 것이다. 포유류를 보면, 착상 전 단계의 초기 배아에 존재하는 PSC는 매우 짧은 G1기를 가짐으로써 분화를 억제하고 PSC의 수를 급속히 증가시킨다. 세포는 G1기에 있을 때 외부 자극에 효율적으로 반응한다는 점을
볼 때, 짧은 G1기를 가지는 PSC는 외부 변화에 둔감할 것으로 생각된다. 하지만 착상 후 삼배엽
분화가 시작되면, G1기 길이가 길어지면서 PSC는 다양한
환경 신호를 받아들이고 종합하여, 어떤 세포로 분화할지를 결정하게 된다. 진화적으로 생성된 세포주기와 줄기세포 간의 상관관계는 복잡한 발생 과정에서 다양한 세포 운명을 만들어내고 조절하는데
효율적인 메커니즘으로 작용을 한다. 또한 세포주기 조절은 발생에 대한 이해를 넘어서 PSC를 이용한 치료제 개발에도 중요한 의미를 가진다. 예를 들어, 환자로부터 유래한 유도만능줄기세포의 경우, 세포주들 간에 매우 큰
분화능 차이를 보인다는 것이 잘 알려져 있으며 이는 유도만능줄기세포를 이용한 세포치료제 개발의 큰 걸림돌이다. 세포주기, 특히 G1기 조절이 PSC의
분화능 조절에 중요한 역할을 하기 때문에 CDK억제제 등을 이용하여 줄기세포 분화를 촉진할 수 있을
것으로 생각된다.
참고문헌
1. Martin, G.R. (1980) Teratocarcinomas and mammalian embryogenesis. Science (80- ) 209:768–776.
2. Martin, G.R. (1981) Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned
by teratocarcinoma stem cells. Proc Natl Acad Sci U S A 78:7634–7638.
3.
Evans, M.J., Kaufman, M.H. (1981)
Establishment in culture of pluripotential cells from mouse embryos. Nature
292:154–156.
4.
Thomson, J.A. (1998) Embryonic Stem
Cell Lines Derived from Human Blastocysts. Science 282:1145–1147.
5. Takahashi, K., et al. (2006) Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast
Cultures by Defined Factors. Cell 126:663–676.
6.
Murray, A.W., Kirschner, M.W. (1989)
Cyclin synthesis drives the early embryonic cell cycle. Nature
339:275–280.
7. Edgar, B.A., Lehner, C.F. (1996) Developmental control of cell cycle regulators: A fly’s perspective.
Science
(80- ) 274:1646–1652.
8. Sherr, C.J., Roberts, J.M. (2004) Living with or without cyclins and cyclin-dependent kinases. G
enes Dev
18:2699–2711.
9. Hogan, B., Beddington, R., Costantini, F., Lacy, E. (1994) Manipulating the mouse embryo: A laboratory manual.
Second
edition. Cold Spring Harb Lab Press. doi:10.1016/0168-9525(86)90275-1.
10. Snow, M.H.L. (1977) Gastrulation in the mouse: Growth and regionalization of the epiblast.
Development
42:293–303.
11. Stead, E., et al. (2002) Pluripotent cell division cycles are driven by ectopic Cdk2, cyclin A/E and E2F activities.
Oncogene 21:8320–8333.
12. Becker, K.A., et al. (2006) Self-renewal of human embryonic stem cells is supported by a shortened G1 cell
cycle phase. J Cell Physiol 209:883–893.
13. White, J., et al. (2005) Developmental Activation of the Rb–E2F Pathway and Establishment of
Cell Cycle-regulated
Cyclin-dependent Kinase Activity during Embryonic Stem Cell Differentiation. Mol
Biol Cell 16:2018–2027.
14. Ruiz, S., et al. (2011) A high proliferation rate is required for cell reprogramming and maintenance of human
embryonic stem cell identity. Curr Biol 21:45–52.
15. Neganova, I., Zhang, X., Atkinson, S., Lako, M. (2009) Expression and functional analysis of G1 to S regulatory
components reveals an important role for CDK2 in cell cycle regulation in human
embryonic stem cells. Oncogene 28:20–30.
16. Gonzales, K.A.U., et al. (2015) Deterministic Restriction on Pluripotent State Dissolution by Cell-Cycle
Pathways. Cell (3):564–579.
17. Choi, S.C., et al. (2012) Nanog regulates molecules involved in stemness and cell cycle-signaling pathway for
maintenance of pluripotency of P19 embryonal carcinoma stem cells. J Cell
Physiol 227:3679–3692.
18. Zhang, X., et al. (2009) A role for NANOG in G1 to S transition in human embryonic stem cells through direct
binding of CDK6 and CDC25A. J Cell Biol 184:67–82.
19. Lee, J., Go, Y., Kang, I., Han, Y-M., Kim, J. (2009) Oct-4 controls cell-cycle progression of embryonic stem
cells. Biochem
J 426:171–181.
20. Yang, V.S., et al. (2011) Geminin Escapes degradation in G1 of mouse pluripotent cells and mediates the
expression of Oct4, Sox2, and Nanog. Curr Biol 21:692–699.
21. Ouyang, J., et al. (2015) Cyclin-dependent kinase-mediated Sox2 phosphorylation enhances the ability of Sox2 to
establish the pluripotent state. J Biol Chem 290:22782–22794.
22. Jang, J., et al. (2016) Primary Cilium-Autophagy-Nrf2 (PAN) Axis Activation Commits Human Embryonic Stem Cells to
a Neuroectoderm Fate. Cell 165:410–420.
23. Coronado, D., et al. (2013) A short G1 phase is an intrinsic determinant of naïve embryonic stem cell
pluripotency. Stem
Cell Res 10:118–131.
24. Bar-On, O., Shapira, M., Skorecki, K., Hershko, A., Hershko, D.D. (2010) Regulation of APC/CCdh1 ubiquitin ligase
in
differentiation of human embryonic stem cells. Cell Cycle 9:1986–1989.
25. Dannenberg, J.H., Van Rossum, A., Schuijff, L., Te Riele, H. (2000) Ablation of the retinoblastoma gene family
deregulates G1 control causing immortalization and increased cell turnover
under growth-restricting conditions. Genes Dev 14:3051–3064.
26. Sakaue-Sawano, A., et al. (2008) Visualizing Spatiotemporal Dynamics of Multicellular Cell-Cycle Progression.
Cell
132:487–498.
27. Pauklin, S., Vallier, L. (2013) The cell cycle state of stem cells determines cell fate propensity.
Cell
155:135–147.
28. Singh, A.M., et al. (2013) Cell-cycle control of developmentally regulated transcription factors accounts for
heterogeneity in human pluripotent cells. Stem Cell Reports 1:532–544.
29. Pauklin, S., Madrigal, P., Bertero, A., Vallier, L. (2016) Initiation of stem cell differentiation involves cell
cycle-dependent regulation of developmental genes by Cyclin D. Genes Dev
30:421–433.
30. Grandy, R.A., et al. (2015) Genome-wide Studies Reveal that H3K4me3 Modification in Bivalent Genes is Dynamically
Regulated During the Pluripotent Cell Cycle and Stabilized Upon
Differentiation. Mol Cell Biol 36:615–627.
첨부파일