
생화학분자생물학회입니다.
과영양 상태에서 Rho-kinase의 간 지방형성 조절에 대한 연구
작성자
관리자작성일자
2019-04-01조회수
626과영양 상태에서 Rho-kinase의 간 지방형성 조절에 대한 연구
Rho-kinase/AMPK axis regulates hepatic lipogenesis during overnutrition
J Clin Invest. 2018;128(12):5335-5350

김상수
부산대학교병원 내분비대사내과
E-mail: drsskim7@gmail.com
Tel: 051-240-7300
연구배경
비만은 한국을 포함해 전세계적으로 그 유병률은 급속히 증가하고
있으며, 제2형 당뇨병, 비알코올성
지방간 및 심혈관질환 등의 위험인자로 잘 알려져 있다. 비알코올성 지방간으로부터 초래되는 대사적인 문제는
큰 사회경제적 문제로 인식되고 있으며, 비만과 제2형 당뇨병에서
그 유병률은 85%에 육박한다. 따라서 비만과 연관된 지방간에
대한 원인 병인론에 대한 활발한 연구가 이뤄지고 있다. 간에서 지질의 유입과 지방 신생합성이 지방의
유출과 산화를 초과할 때 간세포에 지방이 축적되어, 비알코올성 지방간을 일으키게 된다. 간세포에서 과도한 트리글리세라이드의 축적을 일으키는 병태생리는 잘 알려져 있으나, 이것을 조절하는 세포학적 메커니즘은 여전히 불명확한 실정이다.
Rho-kinase(ROCK)은 평활근 수축, 액틴 세포골격 조직, 세포부착과 이동 및 유전자 발현 등의 다양한 세포 기능과 연관이 있으며, 고혈압, 죽상동맥경화증 및 당뇨병과 같은 대사성질환의 병태생리에 관여하는 것으로 알려져 있다. 최근에는 ROCK이 말초에서뿐 아니라, 시상하부에서 혈당 대사, 인슐린 신호전달 및 에너지 대사에서 중요한
역할을 하는 것으로 보고되고 있다. 하지만, 에너지 대사적
측면에서 조직마다 ROCK의 역할이 다른 것으로 여겨지고 있다. 이에
본 연구진은 비만과 연관된 대사질환의 발생에서 있어 간에서 ROCK1의 역할을 규명하고자 하였다.
연구결과
1. 비만 마우스 모델과 지방간을
동반 사람의 간에서 ROCK1 발현과 활성도가 증가한다.
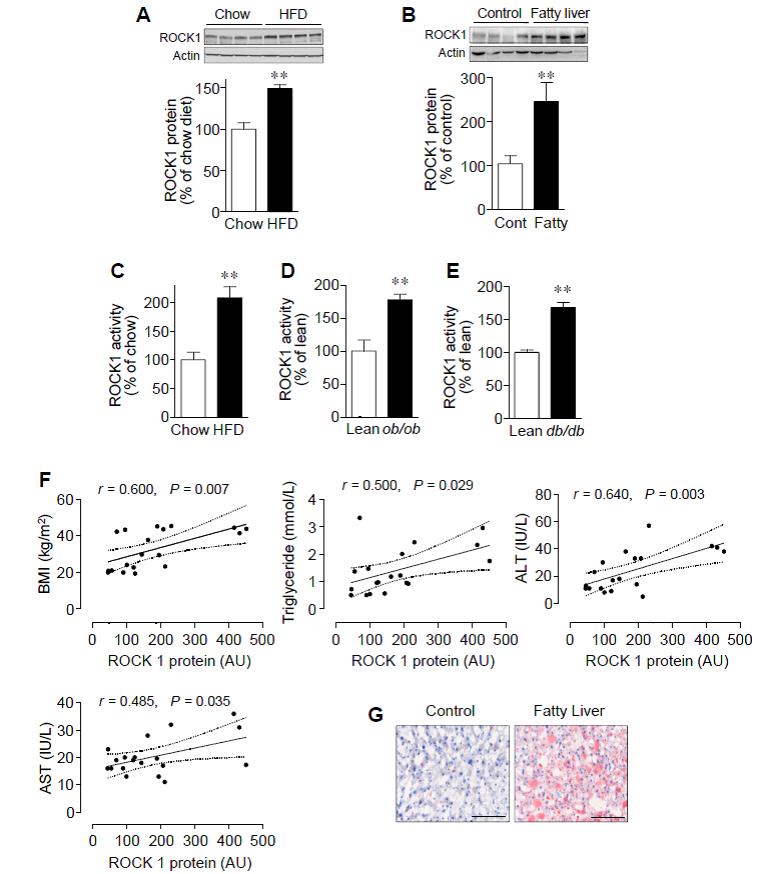
그림 1. 비만 마우스 모델과 지방간을 동반한 사람의 간에서 ROCK1 발현과 활성
본 연구에서 마우스에서 고지방식이를 하였을 때, 정상 대조군에 비해 간의 ROCK1 단백질 발현이 약 1.5배 증가하는 것을 관찰하였다. 또한 고지방식이 모델, ob/ob 마우스, db/db 마우스 모델에서 각각 107% 77%, 68%의 간의 ROCK1의 활성도가 증가되어 있음을 확인하였다. 한편, 사람의 간 조직 검사에서도 지방간을 가지고 있는 사람은 정상 대조군에 비해 ROCK1 단백질이 2.2배 증가되어 있었다. 사람에서 간 ROCK1 단백질 발현의 정도는 지방간과 간손상의 정도를 나타내는 여러 위험 인자들과 강한 연관성을 보였다. 이로써 간의 ROCK1 활성화가 비만과 연관된 비알콜성 지방간의 진행에 역할을 할 것이라는 것을 확인할 수 있었다.
2. 간 특이 ROCK1 결손은 고지방식이에서 비만에 의한 대사 장애를 막아준다.
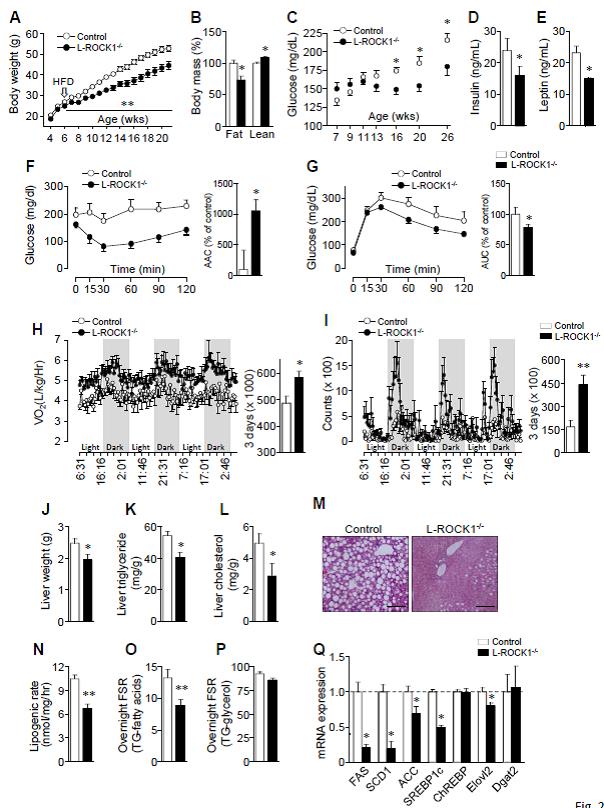
그림 2. 간 특이 ROCK1 결핍은 비만 유도 대사 장애의 예방
간 특이적 ROCK1 결손(L-ROCK1-/-) 마우스를 이용하여 간에서 ROCK1의 생리적 기능을 확인하였다. 정상식이 상태에서는 간에서 ROCK1을 결핍 시켰을 때, 체중, 지방량, 식이 및 인슐린 감수성 등에 영향을 미치지 않았다. 흥미롭게도, 고지방식이 환경에서는 간의 ROCK1 결핍은 대조군에서 발생하는 고지방에 의한 비만이 발생하기 않았다. 식이 섭취량의 차이가 없음에도 불구하고 L-ROCK1-/- 마우스는 대조군에 비해 높은 에너지 소비를 보여 주었다. 간에서 ROCK1을 결손 시켰을 때, 갈색지방에서 열발생 유전자들이 발현이 현저히 증가하였다. 즉, 간에서 ROCK1이 부족한 경우 증가한 에너지 대사의 증가는 일부 열발생 유전자의 발현 증가에 의한 것으로 설명할 수 있겠다. 고지방식이를 준 L-ROCK1-/- 마우스는 인슐린 내성검사와 당내성 검사에서 대조군과 비교하여 현저한 인슐린 저항성의 감소를 보여주었다. 또한 혈청 렙틴의 감소를 보여주였으나, 혈청 지질의 변화를 동반하지는 않았고, 간의 미토콘드리아와 DNA량의 변화는 관찰되지 않았다. 이를 종합해 보면, 간에서 ROCK1 유전자를 제거했을 때 식이 유리지방산의 과다한 섭취 환경에서 식이에 따른 비만을 막아주고 인슐린 저항성을 개선시켜주는 것을 확인할 수 있었다. 반대로 간에서 ROCK1이 과도한 영양공급 상태에서 지방의 축적과 인슐린 저항성을 조장하는 주요 물질임을 시사한다.
3. 간의 ROCK1 de novo lipogenesis를 조절한다.
비만이 지방간을
촉진하기 때문에, 간 특이 ROCK1 결손이 고지방식이에서
지방간 발생을 예방할 수 있는지 확인하였다. 예상대로, L-ROCK1-/- 마우스는 대조군에서 비해
간의 전체 무게와 중성지방 및 콜레스테롤의 양의 감소를 보여 주었고, 이는 조직학적으로도 같은 소견을
보여주었다. 이에 간에서 지질의 축적에 대한 ROCK1의
효과에 대한 세포학적 기전을 확인하였다. 고지방식이를 한 L-ROCK1-/- 마우스는
대조군과 비교하여 2H NMR로 분석하였을
때 생체 내의 de novo lipogenesis(DNL)의 현저한 감소를 보였다. 체중 증가에서 이차적인 효과인 것을 배제하기 위해서, 체중을 일치시킨
L-ROCK1-/- 마우스와 대조군 마우스를 비교하였으며, 정상 식이를 투여한 L-ROCK1-/- 마우스에서도 de novo lipogenesis의 감소를 확인할 수
있었다. 하지만 간에서 ROCK1의 결손은 간세포에서 유리지방산
생성과 섭취와 트리글리세라이드의 분비에 영향을 미치지 않아서, 간에서 지방의 축적이 DNL에 의한 것임을 확인할 수 있었다. 동시에 L-ROCK1-/- 마우스에서는 지방생성관 관련된 주요 유전자의 발현이 현저하게 줄어 있었다(Fas, Scd1, Srebp1c, and Elovl2). 그러나
포도당신합성(Pepck and G6Pase),
해당작용(GK and L-PK)
및 유리지방산 산화(Cpt1
and Ppara)와 관련된 유전자 발현에는 변화를 보이지 않았다. L-ROCK1-/- 마우스와 대조군 마우스의
간에서 Microarray를 시행하였을 때, 지질 대사과정을
포함한 대사 과정에 주로 관여된 유전자의 발현 차이를 보였다.
4. 간 ROCK1 활성화는 고지방식이 환경에서 인슐린 저항성과 지방간을 조장한다.
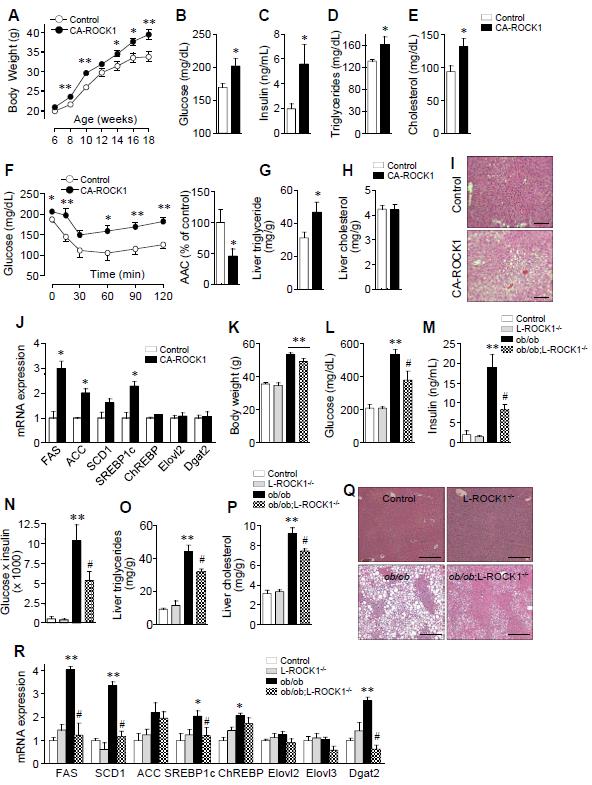
그림 3. 간 지방간 발생에 있어서 ROCK1의 역할
본 연구진은 간에서 ROCK1을 과발현시켰을 때, 고지방식이에 인슐린 저항성의 증가, 비만 및 지방간을 유발시키는지를 확인하기 위해, 간에서 ROCK1가 constitutively active 발현하는 마우스(L-CA-ROCK1)를 제작하여 실험하였다. L-CA-ROCK1 마우스는 정상 마우스에 비해 간에서 ROCK2의 변화 없이 ROCK1의 활성도가 2배 정도 증가하였다. 정상 식이 상태에서는 체중, 혈당의 변화 및 간의 지방생성 유전자의 변화는 관찰되지 않았다. 하지만 고지방식이 상태에서는 L-CA-ROCK1 마우스는 비만해졌고 인슐린 저항성 유도와 함께 간에서 지방의 축적이 증가하였다. L-CA-ROCK1 마우스에서 산소 소비량과 활동량은 변화는 없었다. 마지막으로 간에서 ROCK1의 활성은 지방형성 유전자 발현은 증가시켰으나, 유리지방산 산화와 섭취와 관련된 유전자 발현에는 영향을 미치지 않았다. 따라서, 간에서 ROCK1의 활성은 식이에 의해 유도한 비만 상태에서 인슐린 저항성과 지방간을 일으키는 데 충분할 것으로 여겨진다. L-ROCK1-/- 마우스 결과와 종합해 보면, 간에서 ROCK1은 비만과 연관된 대사질환에서 포도당과 지방의 항상성 유지에 필수적인 요소임을 보여준다.
5. 간 ROCK1 활성화는 엔도카나비노이드 의존성 지방형성 과정에 필수적 요소이다.
비만에 의한
지방간의 병태생리에 있어 엔도카나비노이드 시스템의 역할에 대한 연구가 잘 알려져 있어, ROCK1이 endocannabinoid/CB1 와 연관된 간의 지방형성에 관여하는지 확인하였다. 간세포와 HepG2 세포에서 anandamide(AEA)와 2-arachidonylglycerol(2-AG)를 처리하였을 때, ROCK1의
활성도가 증가한 것을 관찰하고, ROCK1이 카나비노이드 시스템의 하부 요소임을 확인하였다. 동시에 정상 마우스에서 2-AG는 간의 AMPK의 활성을 현저히 감소시켰으나, L-ROCK1-/- 마우스에서는 그런 효과가 없었다. 또한
두 마우스 모델(L-ROCK1-/-
와 L-CA-ROCK1)은 통해, ROCK1의 결핍에 의해 AMPK 활성도가 증가하고, 반대로
ROCK1의 활성화에 의해 AMPK 활성이 감소하는 것을 확인하였다. 이는 ROCK1이 AMPK에
대한 음성적으로 조절(negative regulation)하는 기능을 가지고 있음을 시사한다. 선행 연구처럼, 2-AG는 정상 마우스에서 지방형성에 관여한 유전자의
발현을 증가시켰으나, L-ROCK1-/-
마우스에서는 그런 효과에 대한 장애가 있었다. 전신작용에 따른 이차적인 효과를 배제하기
위해, L-ROCK1-/-
마우스로부터 간세포를 추출하여 배양하여 2-AG를 처치하였을 때에도 ROCK1이 결핍된 경우 정상인 경우와 비교하여 지방형성 관련 유전자들의 현저한 감소한 것을 확인할 수 있었다. 이 결과들로부터 간의 ROCK1의 활성화는 그 하부에 AMPK의 기능을 조절함에 따라 카나비노이드 유도 지방 형성을 조절하는 데 필수적임을 확인할 수 있다.
6. Metformin은 ROCK1의 억제를 통해 간의 지방형성을 억제한다.
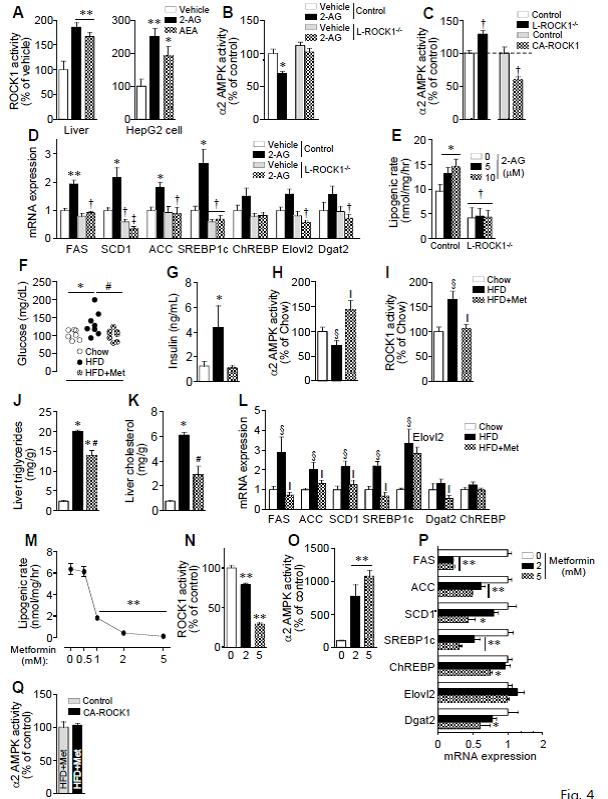
그림 4. 엔도카나비노이드 및 Metformin에 의한 간 ROCK1의 조절
Metformin은 간의 AMPK에 의해 직접적으로 인산화되는 것으로 알려져 있는 SREBP의 활성화를 억제함으로써 지방간 생성을 억제하는 것으로 잘 알려져 있다. 마우스 모델에서 고지방식이는 간의 AMPK 활성화를 감소시켰으며 이는 Metformin에 의해 다시 회복되었다. 흥미롭게도 Metformin은 고지방식이에 따른 간의 ROCK 활성화를 막아주었고, 지방 생성 유전자 발현의 증가를 다시 정상화시켰으며, 간의 지질 축적을 감소시켜주었다. 동시에 정상 마우스에서 분리한 간세포에서 metformin을 처리하였을 때, 지방형성 속도, ROCK1 활성화 및 지방형성 유전자 발현을 현저히 감소시키고, AMPK 활성을 증가시켜 주었다. 그러나 ROCK1이 결손된 마우스로부터 분리한 간세포에서는 AMPK 활성을 증가시키고 지방형성 유전자 발현을 억제하는 Metformin의 효과는 차단됨을 확인할 수 있었다. 게다가 고지방식이를 투여한 L-CA-ROCK1 마우스에 Metformin에 의한 혈당 조절, AMPK 활성화 및 지방형성 유전자 발현 등에 변화가 관찰되지 않았다. 이런 결과로 ROCK1은 AMPK를 활성화시키고 간 지방생성을 억제하는 Metformin의 대사적인 역할을 매개하는 것으로 생각할 수 있다.
7. 간의 AMPK 기능은 지방형성에서 있어 ROCK1의 하부 물질로써 기능을
한다.
마지막으로 ROCK1의 조절하에서 간의 AMPK가 지방형성을 조절하는 데 있어
중요한 역할을 하는지 확인하기 위해서, L-ROCK1-/-
마우스와 L-CA-ROCK1 마우스로부터 분리한 간세포에서 직접적으로 AMPK를 활성화시키거나
억제시키는 실험을 진행하였다. ROCK1이 결손된 간세포는 정상보다 낮은 기저 상태의 지방형성 유전자
발현을 보였다. 또한 AMPK 억제제인 compound C 처리했을 때는 정상 마우스로부터 간세포에는 주요 지방형성 유전자의 발현이 현저히 증가한 반면, ROCK1이 결핍된 간세포에서도 유사하게 증가하지만 그 정도가 줄어들어 있음을 확인할 수 있었다. 반대로, L-CA-ROCK1
마우스에서는 그와 반대되는 결과가 관찰되었다. 종합적으로 이는 AMPK가 ROCK1의 하부 조절물질로 ROCK1 매개 지방형성에 필수적임을 시사한다.
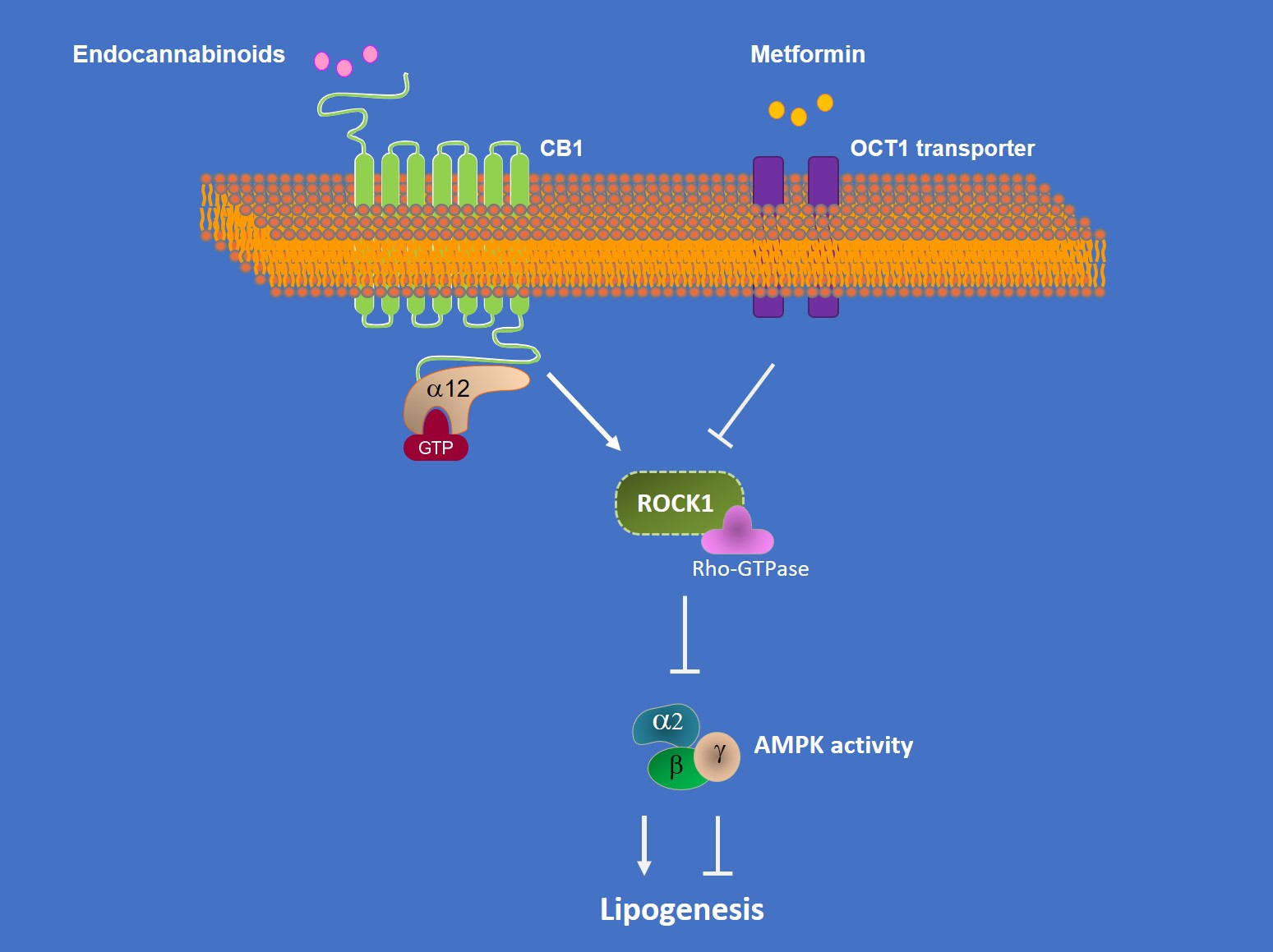
그림 5. 간 대사에서 ROCK1의 역할에 대한 요약
연구의 성과 및 의의
본 연구를 통해
ROCK1이 간의 de novo lipogenesis를 조절함으로써 비만, 인슐린 저항성 및 지방간 질환 등의 주요 병태 생리에 있어 중요한 역할을 함을 확인하였다. 또한 본 연구는 비알코올성 지방간과 같은 대사질환에서 간의 에너지 대사의 조절과 장애를 일으키는 데 있어 『엔도카나비노이드 (메트포민) → CB1 (OCT1) → ROCK1 → AMPK로 이어지는
축』을 증명한 것에 의의를 둘 수 있겠다(그림 5). 또한
비알코올성 지방간질환을 치료하는 주요 타깃으로써 간의 ROCK1을 억제하는 전략이 도움이 될 수 있을
것으로 판단되며, 지방간 질환의 높은 유병률과 개인과 사회에 초래하는 문제점 등을 고려할 때 향후 이연구는
반드시 필요할 것을 판단된다.
참고 문헌
1. Fabbrini,
E. Sullivan, S. & Klein, S. Obesity and nonalcoholic fatty liver disease:
biochemical, metabolic, and clinical implications. Hepatology 51, 679–689
(2010).
2. Furukawa, N. et al. Role of Rho-kinase in
regulation of insulin action and glucose homeostasis. Cell Metab 2, 119–129 (2005).
3. Huang, H.
et al. Rho-kinase regulates energy balance by targeting hypothalamic leptin
receptor signaling. Nat Neurosci 15, 1391–1398 (2012).
4. Lee, SH.
et al. ROCK1 isoform-specific deletion reveals a role for diet-induced insulin
resistance. Am J Physiol Endocrinol Metab
306, E332–E343 (2014).
5. Huang, H.,
Lee, DH., Zabolotny, JM. & Kim, YB. Metabolic actions of Rho-kinase in
periphery and brain. Trends Endocrinol
Metab 24, 506–514 (2013).
6. Li, Y.
et al. AMPK phosphorylates and inhibits SREBP activity to attenuate hepatic
steatosis and atherosclerosis in diet-induced insulin-resistant mice. Cell Metab 13, 376–388 (2011).
7. Zelber-Sagi, S. et al. Serum levels of endocannabinoids are independently associated with nonalcoholic fatty liver
disease. Obesity
(Silver Spring) 25, 94–101
(2017).
첨부파일