
생화학분자생물학회입니다.
Disease Molecule Biochemistry Laboratory (질병분자생화학 연구실)
작성자
관리자작성일자
2019-08-01조회수
918Disease Molecule Biochemistry Laboratory (질병분자생화학 연구실)
김호민
KAIST 의과학대학원, IBS 바이오분자 및 세포구조 연구단, 단백질 커뮤니케이션 그룹
[연구실 소개]
본 연구실은 KAIST 의과학대학원과 IBS 바이오분자 및 세포구조연구단에 소속되어 있으며, 현재 4명의 연구위원 (Post-Doc), 3명의 연구원, 4명의 대학원생으로 이루어져 있다. 본 연구실에서는 생리활성 조절에 중요하게 작용하는 다양한 단백질 복합체들의 3차원 분자구조를 규명하고, 이들의 분자기전에 기반한 생리적·병리적 기능을 통합적으로 탐구하고자 한다. 특히 생리활성을 조절하는 다양한 Leucine-rich repeat (LRR) 단백질들의 새로운 결합 타겟을 발굴하고 이에 의해 조절되는 세포 내 신호전달과 단백질 간 커뮤니케이션을 규명함으로써, 새로운 연구분야 창출을 위해 도전하고 있다. 뿐만 아니라 국제적 경쟁력을 갖춘 4개의 첨단 융합연구인프라 (Cryo-EM, 단백질결정화, 단백질생산, 구조분석 컴퓨팅)를 구축하여 다양한 질병관련 단백질복합체들의 3차원 분자구조를 규명하고, 단백질 구조에 기반한 단백질엔지니어링을 통해 신약후보물질 개발에도 힘쓰고 있다.
[연구내용]
1. Leucine-rich repeat (LRR) 단백질 연구를 통한 면역반응 조절 이해
내독소 (Endotoxin)라고도 불리는 그람음성균의 외막성분인 지질다당류 (Lipopolysacharride, LPS)은 선천성 면역반응을 활성화시키는 주요 원인물질이다. 하지만 박테리아 감염 및 급격한 증식에 따라 내독소가 혈액 내 다량 존재하게 될 경우, 오히려 과도한 면역반응을 일으켜 발병율과 치사율이 매우 높은 패혈증으로 발전될 수도 있다. 내독소가 혈액 내 유입되면 생체 내 두 단백질 (LBP와 LRR 도메인을 가지는 CD14)이 소량의 내독소를 신속히 인지하고, 효과적으로 내독소를 면역세포 표면의 LRR 도메인을 가지는 TLR4와 MD2 복합체로 전달하여 선천성 면역반응을 활성화시키게 된다. 지난 2~30년간 단백질결정학 방법을 통한 LBP, CD14, TLR4-MD2 단백질들의 3차 분자구조 규명 및 다양한 생화학적 연구방법들을 이용하여 내독소 인식 및 전달 관련 많은 연구가 이루어져 왔다. 하지만 내독소 인식 및 전달은 매우 빠르고 동적인 단백질 상호작용에 의해 일어나기에 연구에 많은 어려움을 겪어 왔다. 본 연구진은 최신 바이오투과전자현미경 기법과 단분자 형광기법을 이용하여 이러한 기술적 한계를 극복함으로써, LBP, CD14, TLR4-MD2 단백질들의 상호작용에 의한 박테리아 내독소 인식 및 전달과정의 핵심 분자메커니즘을 규명하였다. 해당 연구를 통해 선천성 면역 유발기전을 이해할 수 있을 뿐만 아니라 패혈증 예방 및 치료제 개발에 큰 밑거름이 될 수 있을 것이다.
![1562911719_[포맷변환]KSBMB_국내외연구실소개_김호민_그림1.jpg](../../data/ksbmb_data/images/smarteditor/1562911719_[포맷변환]KSBMB_국내외연구실소개_김호민_그림1.jpg)
그림1. LRR 단백질들 (CD14, TLR4)과 LBP에 의한 생체 내 박테리아 내독소 전달 메커니즘
2. Leucine-rich repeat (LRR) 단백질 구조연구를 통한 시냅스형성 이해
시냅스는 신경세포들의 접합 부위로서 신경전달물질을 주고받으며 학습 및 기억, 감각, 운동 등이 원활히 조절되게 하는 뇌기능의 기본 단위이다. 발생 중인 태아와 갓 태어난 사람의 뇌에서는 신경세포 사이 접합이 계속 일어나며 흥분성 시냅스 (Excitatory Synapse)와 억제성 시냅스 (Inhibitory Synapse)가
빠르게 만들어지는데, 이 때 시냅스 형성과 흥분성/억제성
시냅스 간의 균형에 문제가 생길 경우, 자폐증과 정신 분열증을 포함한 다양한 신경정신질환 (Neuropsychiatric Diseases)들이 발생하게 된다.
본 연구실에서는 LRR 도메인을 가지는 시냅스접착단백질
Slitrk과 그와 결합하는 LAR-RPTP 단백질 복합체의
고해상도 3차원 구조를 규명하여 새로운 작용 모델을 제시하고 다양한 생화학적, 신경생물학적 실험을 통해 이를 검증함으로써, 두 시냅스접착단백질
간의 결합에 의해 유도되는 시냅스 형성의 새로운 작동 기전을 규명하였다. 그 외에도 다양한 시냅스접착
단백질들의 구조를 규명함으로써 신경·정신질환 치료제 개발에 활용될 수 있는 기초지식을 제공하고자 노력하고 있다.
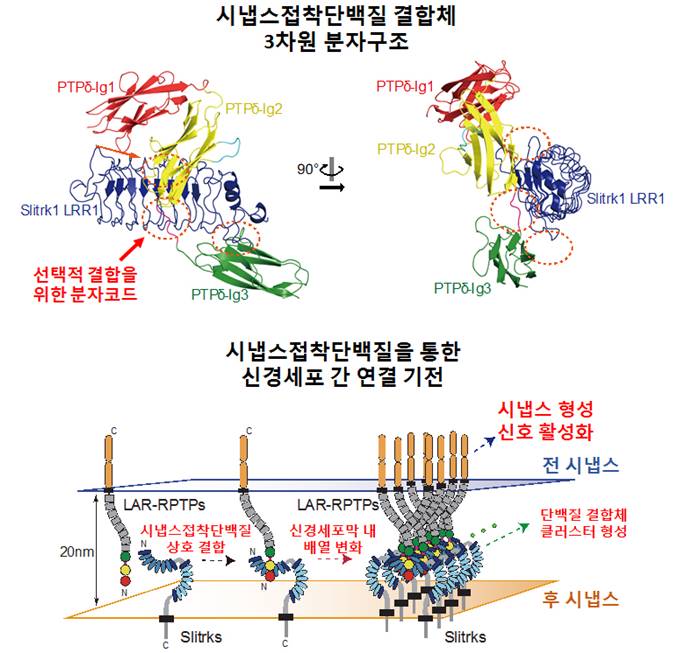
그림2. LRR 도메인을 가지는 시냅스접착 단백질 Slitrk과 LAR-RPTP 복합체의 3차원 분자구조와 시냅스 형성신호 활성화 메커니즘
3. 단백질엔지니어링 기반 신약후보물질 개발
혈관내피세포 성장인자 (Vascular Endothelial Growth Factor, VEGF)는 생리적 혈관신생 기전에 매우 중요한 대표적인 촉진인자이다. 하지만 암 및 노인성 황반변성과 같은 특정 질병상황에서는 과도하게 생성되는 혈관내피세포 성장인자 (VEGF)에 의해 이러한 혈관생성과 소멸의 균형은 깨지게 되고, 이는 질병을 악화시키는 주요 요인으로 작용한다. 혈관내피세포 성장인자 (VEGF) 저해제로 개발된 글로벌 의약품으로는 대표적으로 Avastin (Bevacizumab), Lucentis (Ranibizumab), Eylea (Aflibercept), Zaltrap (Ziv aflibercept) 등이 있으며, 항암치료 및 안구 내 혈관질환 치료 (나이관련 황반변성 및 당뇨망막병증)에 활발히 활용되고 있다. 항체 의약품인 Avastin, Lucentis 와 달리, Eylea와 Zaltrap의 경우 혈관내피세포 성장인자 VEGF가 결합하는 생체 내 VEGF의 세포수용체인 VEGFR의 일부 도메인을 단백질엔지니어링 기술로 설계한 (VEGFR1의 D2 도메인과 VEGFR2의 D3 도메인을 항체의 Fc 부분과 결합시킨 형태) 약물도 크게 각광받고 있다.
본 연구팀은 기존의 Eylea, Zaltrap 보다 혈관내피세포 성장인자와의 결합력과 생체
지속성 면에서 우수한 단백질의약품 후보물질 VEGF-Grab을 개발하였다. 특히 VEGF-Grab은 VEGF가
결합하는 생체 내 VEGFR1의 D2-D3 도메인을 그대로
활용하면서도, 3차원 구조를 기반으로 당쇄화 도입을 통하여 체내 반감기가 늘어나고 약물의 화학적 안정성이
좋아지게 새롭게 엔지니어링한 단백질이다. 다양한 동물모델들에
VEGF-Grab을 투여하여 항암치료 효능 및 망막 혈관질환에서의 혈관신생 억제 효과를 성공적으로 검증하였다.
최근 들어 다중 항원을 타겟팅하는 Bi-specific 항체 개발과 암조직 특이적으로 약물을
전달할 수 있는 기술 개발 등을 통해 항암효과를 높이고, 부작용을 줄이는 항암 항체의약품 개발이 큰
관심을 받고 있다. 본 연구진은 암세포 성장을 저해하는 대장암 치료 항체 Erbitux (Cetuximab) 또는 유방암 치료 항체 Herceptin
(Trastuzumab)의 가변부 (Variable Region)를 VEGF-Grab과 융합시킴으로써, 기존의 VEGF-Grab이 가지는 혈관신생 억제 효과와 더불어 융합시킨 Erbitux
혹은 Herceptin의 암세포성장 억제 효과를 동시에 나타낼 수 있는 신규 후보물질 Cet-VEGF-Grab, Tras-VEGF-Grab을 개발하는데도 성공하였다.
특히, Cet-VEGF-Grab 와
Tras-VEGF-Grab 는 다중 항원 타겟팅 역할 뿐 아니라 암조직 특이적으로 약물이 전달되기 때문에 항암효능은 극대화되면서, 부작용은 최소화 하는데 크게 기여할 수 있을 것이다. 이러한 항체의
가변부 (Variable Region) 을 단일사슬로 연결된 scFv
(single chain Fv)를 VEGF-Grab 과 연결시키는 플랫폼 기술을 활용하여, 최근 들어 각광 받고 있는 면역항암항체와 VEGF-Grab을 융합시키는
후속 연구를 진행 중에 있다.
![1562912018_[포맷변환]KSBMB_국내외연구실소개_김호민_그림3.jpg](../../data/ksbmb_data/images/smarteditor/1562912018_[포맷변환]KSBMB_국내외연구실소개_김호민_그림3.jpg)
그림3. 신약후보물질 개발을 위한 단백질엔지니어링과 효능검증
연구
4. 현재 진행 중인 연구
Leucine-Rich Repeats
(LRR) 도메인은 20~30개의 아미노산으로 구성된 작은 구조적 모티프가 연속적으로 연결되어 있는 도메인으로써, 박테리아에서 곰팡이, 포유류에 이르기까지 다양한 종의 LRR단백질들에서 발견된다. 주로 단백질-리간드 상호결합에 참여하여 다양한 세포기능 조절에 중추적인 역할을 하고 있으며,
특히 사람의 경우 LRR 도메인을 가진 400여
종의 단백질들이 면역 (TLR, CD14), 신경세포 분화 및 시냅스형성 (NTRK, Slitrk), 단백질 분해 (FBXL), 오토파지 형성 (LRRK), 호르몬 인식 (FSHR) 등 다양한 생체 내 생리적, 병리적 현상에 주요 역할을 담당하고 있어 많은 관심을 받아왔다. 본
연구진은 생리활성을 조절하는 다양한 Leucine-Rich Repeat (LRR) 단백질들의 새로운
결합 타겟을 발굴하고 이들의 3차원 분자구조 규명을 통해 분자조절 기전을 이해하며 이들에 의해 조절되는
다양한 세포 내 신호전달 규명을 통해, LRR 도메인을 가진 단백질들의 생리적·병리적 기능을 통합적으로 이해하고자 한다.
![1562912106_[포맷변환]KSBMB_국내외연구실소개_김호민_그림4.jpg](../../data/ksbmb_data/images/smarteditor/1562912106_[포맷변환]KSBMB_국내외연구실소개_김호민_그림4.jpg)
그림4. LRR 도메인을 가지는 다양한 생체 내 단백질들
[연구책임자]

김호민 교수
주소: 34141 대전광역시 유성구 대학로 291 한국과학기술원 의과학대학원 질병분자생화학연구실; 34126 대전광역시 유성구 엑스포로 55 IBS 바이오분자 및 세포구조연구단
전화: +82-42-350-4244; +82-42-878-9400
E-mail: hm_kim@kaist.ac.kr; kimhm@ibs.re.kr
Homepage: https://www.kaistdmbl.org/ ;
https://www.ibs.re.kr/protein/
[연구진구성]
교수 : 김호민
대학원생: 김덕기, 조경희, 김효진, 윤정원
연구위원: 이성규, 한아름, 김도균, 이뻬드로
연구원: 이동선, 홍호정, 노현주
랩매니져: 박미영

첨부파일