
생화학분자생물학회입니다.
Molecular Neurogenetics Laboratory (Suh lab)
작성자
관리자작성일자
2019-12-19조회수
976Molecular Neurogenetics Laboratory (Suh lab)
서재홍 (Jaehong Suh)
Neurology Department
Massachusetts General Hospital / Harvard Medical School
[연구실 소개]
서재홍 교수를 Principal Investigator (PI)로 비교적 최근에 만들어진 본 연구실은 미국 보스턴의 하버드 의대 - Massachusetts General Hospital(MGH)의 신경과(Neurology department)에 소속되어 있읍니다. 주요 연구 내용은 유전자 연구를 통해서 찾아낸 Alzheimer's disease(AD)를 일으키거나 발병 위험을 증가시키는 것으로 알려진 유전자와 돌연변이들이 어떠한 메커니즘을 통해서 질병을 일으키는가를 밝히는 것입니다. 이를 위해서 AD mutation을 발현하는 Mouse를 새로 만들거나 기존의 Mouse model들을 이용하여 뇌에서의 변화에 대해 연구합니다. 또, CRISPR/Cas9을 이용한 Gene editing을 통해서 Human neural cell에서 AD mutation들이 어떠한 변화를 일으키는지를 알아보기도 합니다. 본 연구실의 많은 연구들은 Neurology department의 Mass General Institute for Neurodegenerative Disease(MIND)와 Genetics and Aging Research Unit 내의 다른 랩들과 협력연구로 이루어지고 있으며, 앞으로의 연구는 Postmortem brain tissue sample 등을 이용하여 인간의 질병과 보다 더 상관성이 있는 것에 초첨을 맞추어 나갈 계획입니다. 그리고 지금까지 본 연구실과 PI의 Alzheimer 연구에서 찾은 타겟을 바탕으로 새로운 치료법(Experimental drug)을 개발하는 연구도 시작단계에 있습니다.
[연구 내용]
1. ADAM10 mutations in Alzheimer's disease
ADAM10은 아래의 그림 1에서 보는 것처럼 세포막에 있는 Amyloid Precursor Protein(APP)를 자르는 alpha-secretase인데, 그 자르는 위치가 Amyloid beta(Abeta) 부위의 가운데에 있어서 결과적으로는 Abeta의 생성을 억제하는 역할을 합니다. Abeta는 Alzheimer brain에서 특히 많이 발견되는 노인성반점(senile plaque)의 주요 구성 성분인데, 이 Abeta가 질병을 일으키고 또 진행시키는 원인이라는 'Abeta Hypothesis'가 지금까지 Alzheimer 연구와 치료약 개발에서 가장 중요한 가설이었습니다. 하지만 이 가설을 바탕으로 만들어진 수많은 약들이 최근 몇 년 간의 주요 임상 시험에서 모두 실패했고, 또 이Abeta Hypothesis 자체가 잘못됐다고 생각하는 연구자들도 많이 있습니다. 그렇다고 다른 가설을 바탕으로 개발된 약이 Alzheimer 치료에 성공한 예도 없습니다.
본 연구진은 이전의 연구에서 (2013 Neuron), AD family에서 찾은 ADAM10 mutation이 alpha-secretase activity (APP를 자르는 능력)를 감소시키고 결과적으로 Abeta의 생성-축적을 증가시킬 뿐 아니라, 기억에 결정적인 역할을 하는 대뇌 측두엽의 해마(hippocampus)에서 새로운 신경세포가 생성되는 것을 억제한다는 것을 ADAM10 mouse model을 만들어서 밝혔습니다. 이 프로젝트와 관련하여 현재는, ADAM10이 뇌에서 가지는 다른 기능들을 알아내고 ADAM10을 drug target으로 했을 때 발생할 수 있는 부작용을 줄이기 위해, 뇌에서 novel ADAM10 substrate를 찾는 연구를 하고 있습니다. 더불어 ADAM10에 의해 잘리는 위치에 있는 AD mutation인 APP K687N (혹은 Abeta K16N)을 human neural cell (ReN)과 mouse에 CRISPR/Cas9으로 도입하여 그 효과를 알아보는 연구도 진행하고 있습니다.
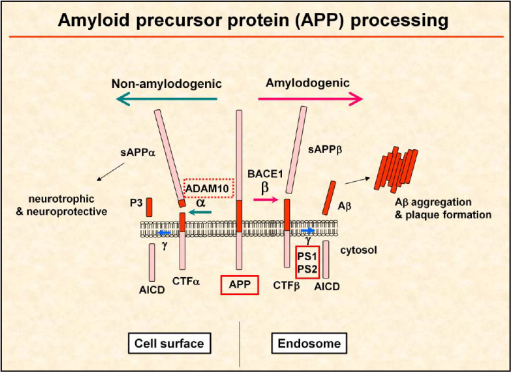
그림1. Amyloid-beta (Abeta)의 전구체인 amyloid precursor protein (APP)은 alpha (ADAM10)-, beta (BACE1)-, gamma (presenilins)-secretase들에 잘리면서 processing된다. Abeta는 aggregation되어 뇌에서 senile plaque을 형성하는 반면, secreted APPalpha는 neuroprotective한 기능을 나타내는 것으로 알려져 있다.
2. Distinctive role of ataxin-1 in spinocerebellar ataxia and Alzheimer's disease
Ataxin-1(ATXN1)은 1993년에 처음 발견된 이래로 많은 후속 연구에서 운동기능과 신체 밸런스에 이상을 일으키는 Spinocerebellar ataxia type (SCA1)의 유전자로 잘 알려져 있었습니다. ATXN1 안의 CAG trinucleotide repeat이 39개 이상으로 팽창한 mutant allele을 하나라도 가지면 SCA1이 발병하는데, 주로 3-40대 이후로 생기는 희귀한 퇴행성 신경 질환입니다. 그런데, 최근 MGH와 다른 연구그룹의 genetic study에서 ATXN1이 Alzheimer와 연관이 있다는 결과가 보고되었습니다. 그래서 본 연구실은 Baylor College of Medicine의 Huda Zoghbi 교수와 MGH의 Rudolph Tanzi교수와의 공동연구를 통해 loss of ataxin-1 function이 beta-secretase인 BACE1의 transcription을 증가시키는 메커니즘을 밝혀냈고, 또 BACE1에 의존한 AD 관련 표현형들(Abeta plaque deposition/gliosis, hippocampal neurogenesis, axonal targeting)을 악화시킨다는 것을 찾아냈습니다 (그림 2 왼쪽; 2019 Cell). 특이하게도 ataxin-1 loss로 인한 BACE1 발현 증가는 AD에 취약한 대뇌(cerebrum)에서만 관찰되었고, 이것은 SCA1에 취약한 소뇌(cerebellum) 및 뇌간(brain stem)과는 정반대의 위치에 있습니다(그림 2 오른쪽). 또한 SCA1 mouse model에서 CAG repeat expansion mutation이 해마(hippocampus)의 CA2 neuron들을 선택적으로 degeneration시킨다는 것을 발견했습니다.
현재는 SCA1 brain에서 어떠한 이유로 CA2 neuron이 degeneration되는지를 밝히는 연구와 함께, ataxin-1 loss of function을 일으키는 AD mutation을 찾아내고 그 effect를 알아보는 연구 등 인간의 기억과 신경질환에 관련된 다양한 연구를 진행하고 있습니다.
그림 2. (왼쪽) Ataxin-1 loss가 어떻게 BACE1의 transcription을 증가시키는지, 또 이렇게 brain내에서 증가한 BACE1이 어떤 AD 관련 변화를 일으키는지를 보여주고 있다. (오른쪽) ataxin-1 양이 줄어들면 AD에 취약한 대뇌에서 BACE1이 증가하고 이에 따른 AD관련 변화가 일어난다. 이에 반해 CAG repeat expansion이 일어나면 ataxin-1 protein은 안정화되고 그 양이 증가하여 대뇌와 반대 위치에 있는 소뇌와 뇌간 등에서 먼저 neurodegeneration을 일으키고 결과적으로 SCA1이 생긴다. "A"의 희미하고 진한 정도는 brain내에서 ataxin-1의 양을 의미한다. Image credit: Emma Brand
[연구책임자]

Jaehong Suh, Ph.D.
Assistant Professor of Neurology
주소:
Genetics and Aging Research Unit
MassGeneral Institute for Neurodegenerative Disease
Massachusetts General Hospital
Harvard Medical School
114 16th Street
Boston, Massachusetts 02421, United States
phone: +1-617-643-6899
fax: +1-617-724-1823
email: suh.jaehong@mgh.harvard.edu
homepage: https://www.mghmind.org/faculty/suh-jaehong-phd
[연구진 구성]

Assistant Professor: Jaehong Suh (서재홍)
Researcher: Donna Romano, Britt DiMarzio, Mary Oram, Abby Lebovitz
(사진의 배경에 보스턴 Charles river와 MIT)
[대표논문]
1. Suh J*,#, Romano DM, Nitschke L, Herrick SP, DiMarzio BA, Dzhala V, Bae JS, Oram MK, Zheng Y, Hooli B, Mullin K, Gennarino VA, Wasco W, Schmahmann JD, Albers MW, Zoghbi HY*, Tanzi RE*. Loss of Ataxin-1 Potentiates Alzheimer's Pathogenesis by Elevating Cerebral BACE1 Transcription. Cell 2019; 178: 1159-1175. PMID: 31442405. *corresponding authors. #Lead contact.
2. Suh J*, Moncaster JA, Wang L, Hafeez I, Herz J, Tanzi RE, Goldstein LE, Guénette SY*. FE65 and FE65L1 amyloid precursor protein-binding protein compound null mice display adult-onset cataract and muscle weakness. FASEB J 2015; 29:2628-39. PMCID: PMC4447227. *corresponding authors.
3. Suh J, Choi SH, Romano DM, Gannon MA, Kim DY, Tanzi RE. ADAM10 Missense Mutations Potentiate beta-Amyloid Accumulation by Impairing Prodomain Chaperone Function. Neuron 2013; 80:385-401. PMCID: PMC4105199.
4. Suh J, Lyckman A, Wang L, Eckman EA, Guenette SY. FE65 proteins Regulate NMDA Receptor Activation-induced Amyloid Precursor Protein Processing. J Neurochem 2011; 119:377-388. PMCID: PMC3188680.
5. Suh J, Im DS, Moon GJ, Ryu KS, de Silva R, Choi IS, Lees AJ, Guenette SY, Tanzi RE, Gwag BJ. Hypoxic Ischemia and Proteasome Dysfunction Alter Tau Isoform Ratio by Inhibiting Exon 10 Splicing. J Neurochem 2010; 114:160-170. PMID: 20374429.