
생화학분자생물학회입니다.
메트포민의 면역 항암보조제로서의 가능성 검증과 PD-L1 발현의 새로운 조절 기전 규명
작성자
관리자작성일자
2019-11-11조회수
1245메트포민의 면역 항암보조제로서의 가능성 검증과 PD-L1 발현의 새로운 조절 기전 규명
Metformin promotes antitumor immunity via endoplasmic reticulum-associated degradation of PD-L1
Molecular Cell, 2018 Aug 16;71(4):606-620.e7. doi: 10.1016/j.molcel.2018.07.030.

차종호
인하대 의과대학 의생명학과 조교수
(E-mail: chajongho@inha.ac.kr) 010-2043-3098
*연구배경
주요한 유전정보의 돌연변이로 촉발된 암세포는 과도한 증식과 함께 유전정보의 변형이 계속해서 축적되는 특성을 가진다. 이러한 이유로 종양 내 같은 기원의 암세포들 간에도 매우 높은 이성질성 (heterogeneity) 을 가지며, 기존의 항암요법들에 대해 상이한 감수성을 나타낼 수 있다. (1) 이러한 경우에 저항성을 가진 암세포가 살아남아 재발을 일으키게 된다. 최근 암의 거대한 이성질성을 면역의 다양성 (immune diversity) 으로 극복하려는 항암면역치료 (cancer-immunotherapy) 가 큰 주목을 받고 있다.
1차 면역 과정에서 수지상 세포 (dendritic cell) 와 백혈구 (macrophge) 와 같은 항원 제시 세포들 (antigen-presenting cells)은 암세포를 대식작용으로 공격한다. 대식작용으로 활성화 된 항원제시세포들은 림프구로 이동해서 비성숙한 T 세포에 암의 항원 (cancer-antigen)을 제시한다(2). 이러한 priming 과정에서 암세포를 특이적으로 인지하고 제거할 수 있는 T 세포가 만들어지는 것이다. 하지만 T 세포가 과도하게 활성화되면 정상 세포도 공격을 할 수 있다. 이를 막고 T세포의 활성을 정교하게 조절하는 우리의 방어기전이 CTLA-4 와 PD-L1과 같은 면역관문 (immune-checkpoint) 단백질들이다 (3). 흥미롭게도 다양한 타입의 암에서 암미세환경이 PD-L1의 발현을 크게 증가시키는 것으로 확인되었다. 암에서 과발현된 PD-L1 수용기가 활성화된 T세포의 PD-1 수용체에 결합하게 되면 T 세포는 활성을 잃고 사멸하게 된다 (4). 즉, 활성화된 T세포가 종양 내로 침투하고 암을 특이적으로 인지하더라도 PD-L1의 발현이 높은 암미세환경에서는 암을 제거하지 못하고 고사하고 마는 것이다. 따라서 암미세환경에서 면역관문 단백질의 과도한 활성을 억제하고 T세포 면역 반응을 정상화하여 암을 제거하려는 여러 면역관문 억제제 (immune- checkpoint blocker : ICB) 가 개발되었다. 현재 Ipilimumab (Yervoy), Nivolumab (Opdivo), Pembrolizumab (Keytruda), 그리고 Atezolizumab (Tecentriq) 가 미식약청의 승인을 받아 면역항암제로 활용되고 있다.
1세대 ICB인 Ipilimumab (anti-CTLA4 antibody) 이 흑색종 환자들에서 보였던 놀라운 반응성과 치료 효과 때문에 타종 암에서도 장미 빛 예후를 기대했지만 10년간의 ICB 임상적용사례를 통해 면역항암제가 매우 제한적인 타입의 암에서만 효과를 보이며 대부분의 고형암에서는 기존의 표적 치료제에 비해 낮은 반응성을 보인다는 실망스러운 결과를 얻게 된다. 하지만 중요한 점은 일단 면역항암제에 반응을 보인 환자군은 기존의 항암요법 처리군에 비해 월등한 장기생존률을 보인는 점이다. 따라서 기존의 항암요법과 면역항암제를 함께 처리하여 높은 반응성과 함께 장기 생존률을 확보하려는 병용요법의 임상 시도가 폭발적으로 증가하게 된다. 하지만 무분별한 병용 시도는 증가 된 자가면역반응 (autoimmune response)과 축척 된 독성을 유발하게 되었고 (5) 따라서 면역항암제를 위한 안전한 보조제 (adjuvant)의 필요성이 대두되고 있다.
이러한 차원에서 본 연구진은 지난 수십년 동안 2형 당뇨병 치료제로 사용되면서 안전성이 충분히 검증 된 메트포민 (metformin) 이 면역항암보조제로써 높은 가능성을 가진다는 것과 그 작용기전으로 PD-L1의 새로운 발현 조절 기전을 규명하였다. 더 나아가서 면역항암제가 효과가 없었던 TNBC 유방암 모델에서 메트포민이 anti-CTLA4 항체와 병용 투여 되었을 때 추가적인 독성없이 anti-CTLA4 항체의 항암효과를 상승적으로 증진시킬 수 있다 것을 제안하였다 (6).
*연구결과
1. 메트포민의 복용은 종양세포의 PD-L1 발현을 억제하고 T세포의 활성을 유지시킴으로써 항암면역을 증진시킬 수 있다.
메트포민이 항암효과를 가지는지 그렇다면 그 효과가 항암 면역에 기인하는 것인지를 확인하였다. 암모델로 4T1 breast cancer syngeneic mouse model을 정상 면역을 가진 Balb/c mouse와 lymphoid 계열에 이상이 있는 SCID Balb/c에 유발하고 종양 생성 후 메트포민을 2주간 투여하였다. 흥미롭게도 정상 Balb/c mouse에서는 메트포민의 항암효과가 명확한데 반해 SCID Balb/c에서는 그 효과가 미미하였다. 이는 메트포민의 항암효과에 면역 반응이 관련되어 있음을 시사한다. 예상대로 암세포를 공격하는 주요 면역 세포인 CD8+ T 세포의 종양 내 침투율과 그 활성 마커인 Granzyme B의 발현이 대조군 종양에 비해 메트포민 처리군의 종양에서 크게 증진되었으며 따라서 종양에 세포사멸을 유도하는 것을 확인하였다. 또한 메트포민에 의해 활성화된 AMPK가 중요한 면역관문 단백질인 PD-L1의 발현을 억제함으로써 T세포의 활성을 유지한다는 것을 in vitro 실험들을 통해 확인하였다.
2. 메트포민에 의해 활성화된 AMPK는 인산화를 통해 PD-L1의 ERAD를 유발한다.
면역에 관련된 막단백질은 고유의 당화과정 (glycosylation)에 의해 특정 당구조 (glycan structure)를 가지게 되며 당구조는 단백질의 세포 내 운송과 그 기능에 있어 매우 중요한 역할을 하는 것으로 알려져 있다 (7). 여러 분자생물학적인 실험들을 통해 메트포민에 의해 활성화된 AMPK가 PD-L1에 직접 결합하여 195번 세린을 인산화한다는 것을 규명하였다. 195번 세린의 인산화는 PD-L1의 endoplasmic-reticulum (ER) trimming에 영향을 주어 PD-L1 단백질이 비정상적인 당구조를 가지게 만든다. 이러한 비정상적인 당구조는 ER에 존재하는 protein quality check complex에 의해 인지되고 PD-L1은 ER에 축척 되었다가 ER associated degradation (ERAD) 경로를 통해 분해되게 된다. 결국 막에 존재하는 PD-L1의 총량이 감소하게 되고 활성이 회복된 T 세포에 의해 암세포가 제거된다 (그림 1).
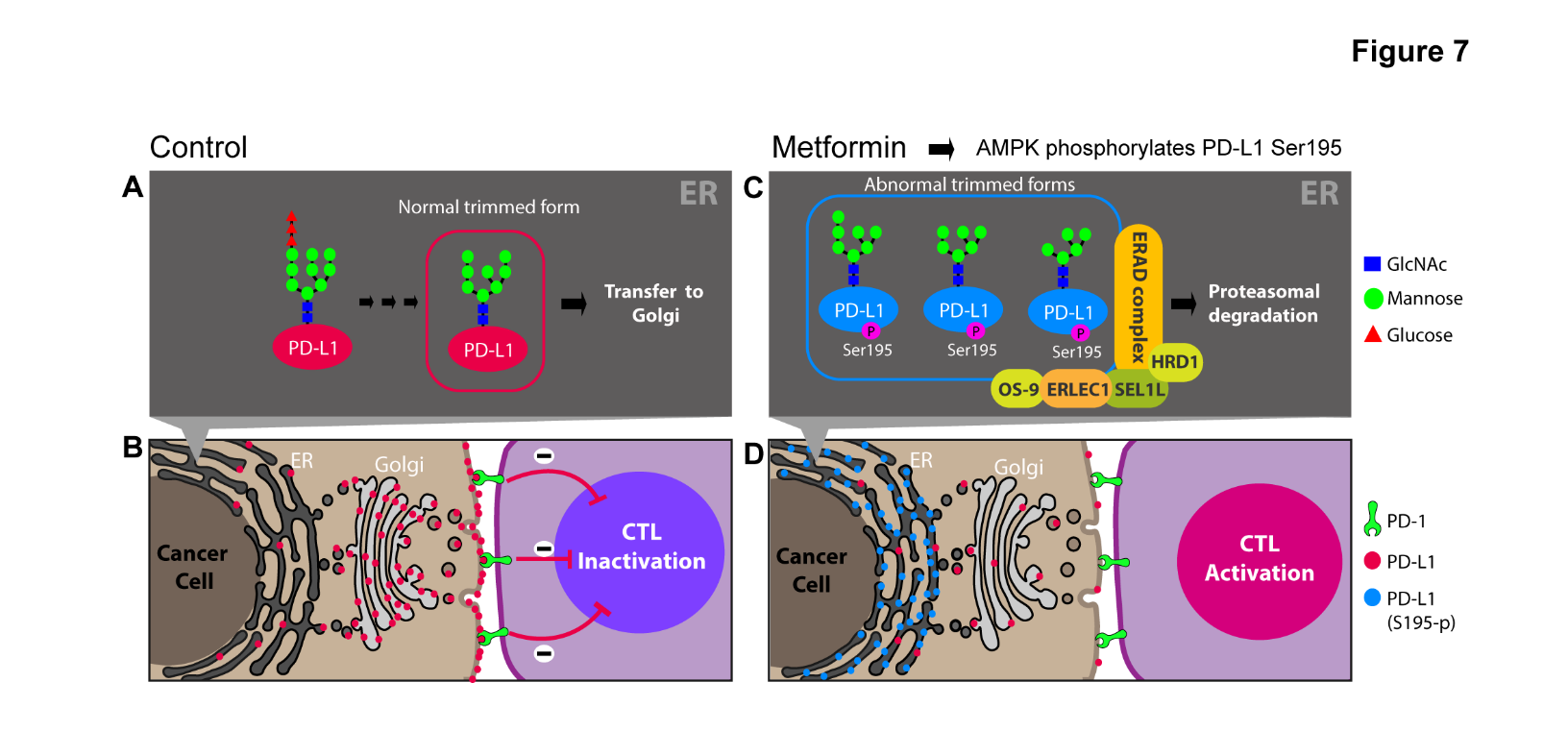
그림 1. 메트포민이 T 세포의 활성을 증가시키는 작용 기전 모델
(A) 정상적인 당구조를 가진 PD-L1 은 ER을 거쳐 Golgi 로 운송된다. (B) 세포막으로 이동한 PD-L1은 CTL (cytotoxic T lymphocyte) 상의 PD-1과 결합을 하고 PD-L1 / PD-1의 억제 신호가 CTL의 활성을 억제한다. (C) 메트포민에 의해 활성화된 AMPK는 PD-L1의 195번 세린을 인산화 한다. 이 인산화는 ER trimming에 영향을 주어 PD-L1이 비정상의 당구조를 가지게 하고 ERAD 경로에 의해 분해되게 한다. (D) 세포막에 존재하는 PD-L1의 총량이 감소함에 따라 CTL이 활성화되어 암세포를 제거한다.
본 연구진은 메트포민에 의해 활성화된 AMPK가 인산화를 통해 PD-L1의 분해를 유발하고 이로 인해 증가된 T세포의 활성이 암세포를 제거한다는 작용 기전을 In vitro 실험을 통해 규명하였다. 이러한 결과를 생체에서 검증하기 위해 mPD-L1의 194번 세린 (hu PD-L1의 195번 세린에 해당함) 을 mutagenesis를 통해 치환하여 mPD-L1 S194E (phospho-mimic form)와 mPD-L1 S194A (non-phospho form) mutant (MT)을 제작하였다. 그리고 각 MT PD-L1을 발현하는 4T1 세포들과 Wild-type (WT) mPD-L1을 발현하는 4T1세포의 종양 형성 정도를 비교하였다. 그 결과 4T1 mPD-L1 WT 과 비교해서 4T1 mPD-L1 S194E는 메트포민을 처리했을 때와 유사하게 항암면역반응이 증가하면서 종양 형성이 억제되었다. 일맥상통하게 4T1 mPD-L1 S194A의 경우는 메트포민의 효과가 크게 떨어졌다. 더 나아가 외과적 수술이 가능한 17명의 유방암환자들에게 메트포민을 처리하고 규명한 작용 기전을 검증하였다. 메트포민 투여 전후로 생검을 실시하여 암조직을 확보하고 AMPK의 활성 마커와 PD-L1의 양을 확인하였다. 메트포민 처리 후 AMPK의 활성에 변화가 없었던 10명의 환자군 (메트포민 비반응군)에서는 AMPK의 활성과 PD-L1의 발현에 어떠한 연관성도 관찰 할 수 없었던 반면 AMPK의 활성이 증가한 7명의 환자군 (메트포민 반응군) 중 6명에서 PD-L1의 양이 명확하게 감소하였다. 이러한 결과들은 메트포민의 작용 기전이 생체에서도 작동한다는 것을 의미하며 따라서 메트포민의 면역항암보조제로써의 높은 가능성을 시사하는 것이다.
4. 메트포민의 병용투여는 anti-CTLA4 항체의 항암 면역치료 효과를 상승적으로 증진시킨다.
이상의 기전 연구와 생체 검증을 통해 메트포민이 PD-L1/PD-1 경로를 효과적으로 억제한다는 것을 확인하였으므로 병용요법의 상대 ICB로 anti-CTLA4 항체를 선택하였다. 메트포민의 병용투여는 4T1 breast cancer 와 CT26 colon cancer syngeneic mouse model에서 anti-CTLA4 항체의 항암면역효과를 상승적으로 증진시켜 종양의 성장을 효과적으로 억제하였다. 각 양물에 대한 단독처리군이 생존률을 향상시키지 못하는데 반해 병용 투여는 생존률을 4T1과 CT26 모델에서 각각 50% 와 80%까지 향상시켰다. 또한 생체 독성 테스트를 통해 디자인된 병용요법이 추가적인 독성을 유발하지 않는다는 것을 확인하였다.
*연구의 성과 및 의의
본 연구의 주요 대상인 TNBC (triple negative breast cancer)는 전체 유방암환자의 15-20%를 차지하며 주로 젊은 층에서 발생한다. TNBC는 에스트로겐 수용체 (Estrogen receptor)와 프로게스테론 수용체 (Progesterone receptor) 그리고 인간 상피성장인자 수용체 (HER2)가 발현되지 않으므로 기존의 호르몬 치료와 표적 치료에 반응하지 않는다 (8). 따라서 TNBC에 대한 대안적 치료로 면역항암제가 고려되고 있지만 TNBC환자에 대한 Ipilimumab의 단독 임상 실험은 실패로 결론지어졌다 (9). 이러한 임상 결과를 반영하듯 본 연구의 TNBC동물 모델에서 anti-CTLA4 항체의 단독 투여군에서는 생존률에 큰 변화를 관찰할 수 없었다. 하지만 메트포민의 병용 투여로 anti-CTLA4 항체의 항암면역효과가 상승적으로 향상되었으며 동물 모델의 생존률이 50%까지 증진되었다. 이러한 결과는 난치의 TNBC에 새로운 치료 요법을 제안했다는데 의약학적 의의가 있다고 하겠다. 또한 개발된 병용요법은 면역고갈 (immune desert)을 특징으로 하는 다른 고형암들에도 적용할 가치가 있다. 더불어 본 연구를 통해 주요한 면역관문 단백질인 PD-L1의 안정성에 중요한 인산화 사이트와 새로운 발현 조절 기전이 규명되었다는 점에서 면역 암생물학적 의미가 있다고 하겠다.
*참고문헌
1. Barcellos-Hoff MH, Lyden D and Wang TC (2013) The evolution of the cancer niche during multistage carcinogenesis. Nat Rev Cancer 13, 511-518
2. Gajewski TF, Schreiber H and Fu YX (2013) Innate and adaptive immune cells in the tumor microenvironment. Nat Immunol 14, 1014-1022
3. Pardoll DM (2012) The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer 12, 252-264
4. Chen L and Han X (2015) Anti-PD-1/PD-L1 therapy of human cancer: past, present, and future. J Clin Invest 125, 3384-3391
5. Champiat S, Lambotte O, Barreau E et al (2016) Management of immune checkpoint blockade dysimmune toxicities: a collaborative position paper. Ann Oncol 27, 559-574
6. Cha JH, Yang WH, Xia W et al (2018) Metformin Promotes Antitumor Immunity via Endoplasmic-Reticulum-Associated Degradation of PD-L1. Mol Cell 71, 606-620 e607
7. Ferris SP, Kodali VK and Kaufman RJ (2014) Glycoprotein folding and quality-control mechanisms in protein-folding diseases. Dis Model Mech 7, 331-341
8. Plasilova ML, Hayse B, Killelea BK, Horowitz NR, Chagpar AB and Lannin DR (2016) Features of triple-negative breast cancer: Analysis of 38,813 cases from the national cancer database. Medicine (Baltimore) 95, e4614
9. Li Z, Qiu Y, Lu W, Jiang Y and Wang J (2018) Immunotherapeutic interventions of Triple Negative Breast Cancer. J Transl Med 16, 147
첨부파일