
생화학분자생물학회입니다.
근육 질환(Muscle diseases)
작성자
관리자작성일자
2018-08-01조회수
1129근육 질환(Muscle diseases)
1. 서론
생명과학의 발달로 다양한 질병의 치료법의 개발이 지속되고 있음에도 일부의 경우 그 치료법을 찾는데 난항을 겪고 있다. 다양한 생물학적 요소 또는 생물학적 이해의 부재가 치료법 개발의 장벽이 될 수 있다. 예를 들면 소위 Pleiotropy라는 불리는 현상, 즉, 하나의 유전자가 한가지 이상의 형질에 관여하거나 다른 유전자들과 조합을 이뤄 상호작용을 하여 특정 형질을 생성함으로 그 유전자 또는 유전자 조합에 의해서 형성되는 생물학적 현상 또는 기능의 예측이 생각보다 단순하지 않을 수 있기 때문이다. 특히 유전성 근육 질환의 경우 원인 유전자의 변인은 이미 있음에도 유전자 및 세포 치료의 기술적 한계와 우리의 예상보다 복잡하게 형성되는 것으로 보이는 병리학적 문제를 유발하는 요인을 분자세포생물적으로 이해하지 못하기 때문에 효과적인 치료법 개발에 난항을 겪고 있다고 할 수 있다.
근육 질환의 발병률은 지역마다 조금씩 차이가 있지만 대부분의 경우 희귀질환으로 우리나라의
경우에도 발병률이 높지 않아 중년에서 노년이 되면 하나쯤은 발견되는 암 또는 대사질환과는 다르게 그 관심이 적다.
또한 사람과 동물의 생물학적 차이 때문에 전임상 연구에서 관찰된 효능이 임상 실험에서는 효과가 없는 경우가 적지 않다. 각 근육 질환 기저에 위치한 분자세포생물학적 요인과 기전을 이해한다면 더 효과적인 약물 및 실험 모델 개발에도
도움이 될 것으로 사료된다.
필자는 임상 교육을 받지 않은 분자생물학자로, 각
질환과 관련된 분자세포생물학적 기전을 모두 밝힐 수만 있다면 (혹은 일부라도 정확하게 알 수 있다면) 치료제 및 치료법 개발에 도움이 될 수 있을 것이라고 믿고 있다. 이와
같은 개인적 관심을 기반으로 필자와 유사한 관심을 가질 수 있는 연구원들을 위해서, 주로 많이 연구되고
있으며 특히 개인적으로 관심을 가지고 있는 근육 질환들에 관련된 정보를 요약해보았다. 이 글의 말미에
필자가 서술한 시도 가능한 치료법은 필자의 관심에 상상력이 추가된 아이디어를 형식에 얽매이지 않고 서술해보았다.
2. 근육 질환
2-1. Duchenne Muscular Dystrophy (DMD, 뒤센 근이영양증)
이 근육 질환은 진행성 근이영양증 중 가장
빈도가 높은 X 염색체 열성(Sex-Linked Recessive) 유전성
근육 질환으로 발생률(Incidence Rate)은 출생 남아
3,500명 당 한 명이며, 지역에 따라 조금씩 차이가 있다고 한다
DMD 환자의 근육에서는 근초(근육세포의 세포막, Sarcolemma) 손상으로 외부에서 Ca2+ 유입이 증가하여 Calpain(Calcium-Dependent,
Non-Lysosomal Cysteine Proteases; EC 3.4.22.52, EC 3.4.22.53, EC 3.4.22.54) Protease가
비정상적으로 활성화된 것이 관찰된다. 이는 근육 내의 구조단백질을 포함해서 여러 가지 단백질을 비정상적으로
분해할 수 있고, 이로부터 근육 질환의 증상이 악화될 수 있다
DMD(Dystrophin) Gene의 23번 Exon에
Stop Codon이 있어 기능을 잃어버린 DMD 단백질이
만들어지는 돌연변이를 가지는 생쥐 모델(mdx
생쥐)이 DMD 질환의 대표적인 실험동물 모델이다. 생후 3주 후에 골격근 괴사가 일어나고 장기간에 걸쳐 근육 퇴화와
재생이 반복되며 괴사가 점점 줄어들 때까지 반복된다. 12~16주령이 되면 DMD 환자와 비슷한 병리학적 특징이 나타나지만 증상이 상대적으로 덜 심하고 심장근 질환이나 섬유화는 상당히
늦은 수준으로 나타난다
현재 주로 쓰이는 치료 방법은 스테로이드
제재 등을 이용한 대증요법과 물리치료를 중심으로 이뤄지고 있다. 2016년 9월 FDA로부터 예외(?)적으로
시판 허가를 받은 Exondys51(Eteplirsen, AVI-4658) 신규 치료제가 있다 (13). 이는 돌연변이 Exon 51을 표적으로 하는 Morpholino Antisense Oligomer(ASO)를
이용하여 Exon 51 Skipping하는 방식을 적용한 약물이다.
Exondys51은 DMD 환자의 약 15%에만
적용된다고 알려져 있다. 다르게 말하자면 다른 형태의 돌연변이를 가진 DMD 환자에게는 새로운 형태의 ASO가 필요하다는 의미이다. 이 외에도 “Translational Read-Through”방식
또는 Utrophin 발현을 증가시키는 형식의 Small Drug이
EMA 또는 FDA 허가를 받았거나 기다리고 있다
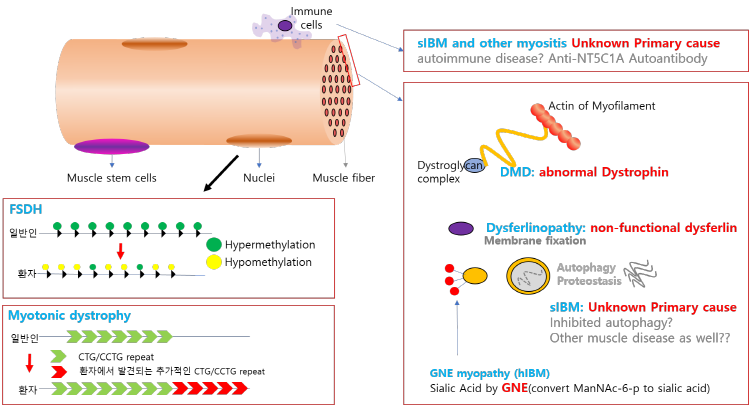
그림 1. 근육질환 관련 유전자 및 분자세포생물학적 현상
2-2. Becker Muscular Dystrophy(BMD, 베커 근이영양증)
앞서 설명한 DMD와 똑같이 X 염색체에 있는 DMD(Dystrophin) Gene의 돌연변이
때문에 발생하는 X 염색체 열성(Sex-Linked Recessive)
유전성 근육 질환이다. DMD에 비해 Reading Frame은
상대적으로 잘 보존되어 있어 DMD 단백질이 비정상적이고 불완전하지만 어느 정도 기능할 수 있는 정도로
발현하여 증상은 Duchenne Muscular Dystrophy에 비해 덜 심하다. 전체 환자의 절반 정도는 10대에 발병하며, 30~60대에 발병하는 경우도 있으며, 발병 시기가 늦을수록 병의
진행속도는 느린 것으로 알려져 있다
2-3. Myotonic dystrophy
상염색체 상의 Myotonic Dystrophy Protein Kinase을 코딩하고 있는 DMPK 유전자(Myotonic Dystrophy Type 1) 또는 Cellular Nucleic Acid-Binding Protein을 코딩하고 있는 CNBP 유전자(Myotonic Dystrophy Type 2) 상의 이상으로
발생하는 근육 질환이다
Myotonic Dystrophy
Type 1(DM1)의 경우 발병 시기는 10~20대이며 골격근육, 심장, 호흡계, 신경계, 소화계에
영향을 끼친다. 일반인은 DMPK의 mRNA 3’UTR 부위에 CTG Repeat이 약 5~34개 정도(코카서스 인종 기준)이지만 환자들은
50개를 초과한다
Myotonic Dystrophy
Type 2(DM2)의 경우 CNBP의 인트론에 있는 (CCTG)n의
수가 늘어나 발병하게 되며 발병 시기는 10대 때 발병하는 경우도 있지만 보통 30대 이후이다. 정상인은 11~26개의
CCTG 반복 서열이 관찰되는데, 환자는 50개를 초과하는 CCTG 반복 서열이 나타난다
DM1과 DM2
Type에 대한 치료법은 아직 나오지 않았지만 현재 Antisense Oligomer (ASO)를
이용한 치료를 in vivo와
in vitro에서 성공하여
임상시험을 준비 중이라고 알려졌다 (25, 26).
2-4. Facioscapulohumeral
Muscular Dystrophy(FSHD)
FSHD는 질환의 이름에서 유추할 수 있듯이 얼굴(Facio), 어깨/등(Scapula),
윗팔(Humeral)의 근육이 약해지는 증상을 보인다.
FSHD 학회에 의하면 약 20,000명 중 1명
정도의 빈도로 발생하고 우성으로 나타나는 상염색체 상의 돌연변이에 의해 발병하는 질환이다
FSHD 환자의 약 95%에 해당되는 FSHD Type 1은 염색체 4q35에 위치하고 있는 Macrosatellite Repeat(D4Z4) Elements의
이상으로 발생하는 것으로 알려져 있다
FSHD Type
2의 경우 이 부위는
정상이지만 염색체 4q35 부분의 Hypomethylation을
유발할 수 있는 돌연변이에 의해서 발생한다. Type 2의 많은 경우가 SMCHD1 혹은 DNMT3B 유전자에 변이가 생기고 Type 1과 같이 D4Z4 부위에 Hypomethylation에 의한 Chromatin Structure 변화가
발생한다 (27-29). Hypomethylation이 일어나면, 전사 인자를 코딩하고 있는 DUX4 유전자가 과발현되어 질환이 발생하는 것으로 추정하고
있다. DUX4 전사 인자는 세포사멸 및 염증반응에 관여하는 유전자 발현에 역할을 한다는 다수의 in vitro 연구가 있다 (29).
FSDH Type
1의 발병 원인인
Macrosatellite Repeat(D4Z4) 부위의 구조와 전사 인자 DUX4의 결합 서열(Binding Sequences)의 차별성은
영장류에서만 확인되는 것이라 생쥐 모델에서는 한계가 존재한다. 생쥐에서 인위적으로 DUX4의 발현을 증가시킬 경우 세포 내 독성이 있어 Embryo Lethal이
나타나기도 한다. 하지만 6~8주 된 쥐에 DUX4를 발현양이 증가되게 하는 Adeno Associated Virus(AAV6-DUX4)를
투여할 경우 1주일 정도 후에 근육 조직의 퇴화나 세포 사멸 일으키는 Caspase3 활성이 증가되는 것을 관찰할 수 있다. 흥미로운 것은
p53 Null Mutation 쥐에서는 이런 현상이 덜 나타나므로 p53에
의존적인 방식으로 일어나는 것으로 추정되고 있다. AAV6-DUX4 투여 1~2주 후에는 근력 약화가 관찰되기도 하지만 3주가 지나면 다시 원래대로
되돌아온다 (30). 이외에도 사람에게서 FSDH를 일으키는 것으로 알려진 부위를 쥐에게 도입시켜 만든 D4Z4 2.4 생쥐
모델도 연구에 사용하기도 한다. 하지만, 이 모델은 전체적으로
DUX4의 발현이 증가되어 있으며 D4Z4 부위의 Hypomethylation도 일어나 있음에도 어떤 병리학적 특징도 않는다. 이것은
질환에 다른 복합적인 요소들이 관련되어 있기 때문이지 않을까 추정할 수 있다. 이 모델은 이와 같은
병리학적 증상의 차이로 약물 효능평가 등의 전임상 연구 모델로서는 부적합하나, 분자생물학적 현상은 유사해
D4Z4와 관련된 기전 연구에 도움을 줄 수 있을 것으로 보인다.
FSDH Type 2의 동물 모델은 아직 만들어지지 않았다 (30).
다른 유전성 근육 질환과 마찬가지로 완치법은
없다. 수술적 방법, 운동/물리치료, 대증요법이 알려진 치료법이다. 임상시험이 진행 중인 aTyr Pharma의 ATYR1940 (RESOLARIS™)이 FSHD와 함께 LGMD 및 DMD
치료제로 가능성이 평가 중에 있다. DUX4를 표적으로 하는 Morpholino ASO를 개발하는 연구도 진행 중이다(31).
2-5. Dysferlinopathy
Dysferlinopathy는 Distal Myopathy를 나타내는 Miyoshi Myopathy와 Proximal (Pelvic and Shoulder)
Weakness를 나타내는 Limb-Girdle Muscular Dystrophy Type 2B
(LGMD2B)를 포함하는 질환이다 (32, 33). Miyoshi Myopathy (MM)는 20~30대에
몸의 말단 부위 근육에서부터 점점 근육 위축과 저하가 일어나기 시작하며 주로 종아리 근육(Gastrocnemius와
Soleus)이 영향을 받는다. 발병 후 몇 년 뒤에는 대퇴
부위 근육으로 증상이 확대된다
상염색체 열성 유전성을 보이는 Dysferlinopathy의 원인은 Dysferlin (DYSF) 유전자의 돌연변이에 의한
기능상실이다. DYSF는 근육의 세포막(근초, Sarcolemma)에 존재하는 막단백질(약 220kd)로 N-terminal에는 Calcium-dependent Phospholipid Binding Domain(CPBD)을 가지고 있고, C-terminal에는 Transmembrane Domain을 가지고
있다. NTD에 CPBD가 있어 칼슘 시그널에 의해서 활성화되어
손상된 근초를 복구하는 기능을 가지는 것으로 알려져 있다 (35). 근초의 손상이 지속적으로 증가되면 염증반응, 세포사멸, 세포 내 칼슘 농도 증가에 의한 미토콘드리아 기능 저해
등과 같은 이유로 질환이 발생하고 진행되는 것으로 추정되고 있다. 하지만 이와 같은 DYSF의 근초 복구 기능의 상실이 MM에서 나타나는 특정 근육 중심의
약화 및 손실의 현상을 설명하고 있지는 못하다. 최근에는 DYSF가
근육 재생과 염증반응에도 관여할 수 있으며, DYSF 부재가 염증 반응과 Muscle Stem Cells(MuSCs) 결핍을 가져올 수 있음이 보고되었다 (35, 36). LGMD2B의 유병률이나 발병률 역시 많이 알려져 있지 않다. 북부 영국을 대상으로 한 연구에 의하면 LGMD2B는 1,000,000명당 약 1.3명이 발병하는 것으로 알려져 있다
2-6. Laing Distal Myopathy (LDM)
상염색체 상의 유전자 Myosin
Heavy Chain 7(MYH7)에
변이(Heterozygous Pathogenic Variant)가 생겨 발생하는 상염색체 우성 유전
질병이다 (38, 39). 1995년 Laing et al.에
의해서 보고되었다
Dysferlin을 Knockout시킨 생쥐가
동물모델로 사용되고 있다. 이 모델의 경우 2개월령 정도가
되면 근위근(Proximal Muscle)과 복근(Abdominal Muscle)
부위에서 근육 약화가 나타난다. 5개월 정도가 되면 종아리 근육(Gastrocnemius, Soleus, TA)에서도 근육 약화가 관찰되며, 혈중
Creatine Kinase의 양도 증가한다. 증상의 진행
속도나 심한 정도는 mdx Mouse와 비슷하나 실제 환자보다는 느리고 증상이 덜 심한 편이다. 각
실험실마다 사용하는 dysferlin Deficient 모델 간의 차이와 증상을 평가하는 방법에 대한 표준화의 부재로, 최근 개발 중인 치료법들(AAV Vector 이용 유전자치료, 항산화제, Exon-skipping 약물, Rho-Kinase 억제제, 줄기세포 이식, Read-through 약물)의 효과를 평가하기 어려운 실정이다. 따라서 정확한 모델 확립과 평가에 대한 표준화가 필요한 상황이다
2-7. Inflammatory Myopathy(IM)
골격근에 염증이 생기는 것이 주요 특징으로 5~15세의 아이나 40~60대의 성인에게서 나타난다
IM 동물 모델 중에는 TRE-H-2Kb (Tetracycline-Responsive
Element MHC Class I) Transgenic 생쥐라는 모델이 있다. 연구자들은
항염증 작용과 근재생에 상관관계가 뚜렷하지 않다는 임상 연구를 기반으로 염증에 직접 관여하는 면역체계와 상관없이 근손상 또는 근위축을 유발할 것을
가설로 세웠고, 그 가설을 평가하기 위해서 위의 TRE-H-2Kb (Tetracycline-Responsive
Element MHC Class I) Transgenic 모델을 개발하였다. 이 모델의
경우 5주령까지는 Doxycycline를 공급하다가 중단하면
15주령부터 단핵세포 침입, Fast/Slow Twitch 근육
약화, 근섬유화 증상이 나타나기 시작한다. 흥미로운 것은
5주령까지는 Doxycycline 투여되고 약 3-8주 동안 Doxycycline 투여하지 않은 모델에서 염증에 관련된
지표인 CD3zeta, CD3epsilon, CD4, CD8, CD20, Elastase, CD83, CD94의
mRNA가 검출되지 않는다. 따라서 면역과 관계된 세포들(T Cells, B Cells, Neutrophils, NK Cells)이 거의 없다. 이는 임상 연구에 관찰을 근거로 확립한 가설에 부합하는 현상이다. 이
모델에서 에너지 대사와 관련된 AMP Deaminase(AMPD1)가 Control 생쥐에 비해 88.2%나 감소하는 것을 관찰되었으며, 이 현상은 병리학적 증상이 나타나기 전에 발생한다. 또한 다른 근육
질환에서는 보이지 않고 Myositis에서만 관찰되는 것으로 볼 때 자가면역 외에 근육이 약화되는데
기여하는 다른 요인을 발굴한 것으로 믿어지며 이와 관련된 추가적인 연구가 필요하다(43).
a. Polymyositis (PM)
주로 어깨와 둔부에 근력 저하가 생겨 앉았다 일어서거나 팔을 머리 위로 올리는 데 어려움을 겪고 삼키는 것에도 장애가 있어 음식물이 폐로
넘어가 폐렴이 발생하기도 한다. 여성이 남성보다 2배 정도
발병률이 높으며 주로 45~60세에 발병하며 드물게 5~15세의
아이에게서 나타나는 경우도 있다 (44). 다른 염증성 근육 질환들과의 공통점이 많아 정확한 진단을 받기 위한 기준으로
근위근 저하, 골격근 효소(Creatine Kinase, Aspartate
Transaminase, Alanine Transaminase, Lactate Dehydrogenase)의 증가, 근육세포의 전위 이상, 생검된 근육조직의 이상 등이 있다. 하지만 이 또한 한계가 있어 정확한 분류를 위해 최근에는 자가 면역질환과 관계가 있는 만큼 이와 관련된 자가항체의
종류에 따라 질환을 분류하기도 한다
병리학적 특징은 T-Cell이 매개하는 자가면역질환으로. IL-1,
6, 15와 함께 질환을 일으킬 것으로 추정된다. 저산소증(Hypoxia)에 관여하는 HIF-1a와 그 하위의 조절을 받는 유전자들이
과발현되어 있는 것도 관찰되었다. 환자들 중 일부는 레트로바이러스에 감염되어 바이러스의 펩타이드가 결합하는
세포독성 T세포의 수용체 때문에 발병하는 경우도 있다. IBM에서
관찰되는 자가포식 액포(Autophagic Vacuoles)가 관찰되기도 한다 (45, 46).
완치 가능한 방법이 아직 없어 면역억제, 물리 치료 등을 중심으로 약물 치료의 경과를 보며
합병증을 막는 방향으로 진행하고 있지만 염증성 근육 질환의 정확한 분류와 임상실험과 관련된 보고, 사례, 결과가 부족하여 적절한 약물을 적용하는데 어려움을 겪고 있다. 약물
치료로는 스테로이드 계열을 사용하고 효과가 없거나 부작용이 나타나면 다른 약물을 사용해야 하는데 CD20을
표적으로 하는 Rituximab이 치료제로 널리 사용되고 있다. T세포의
CD28을 표적으로 하는 Abatacept는 현재 임상 2상에 진행 중이다. 류마티스 관절염에 효과가 있는 Anakinra를 환자에게 투여해본 실험에서는 일부 환자는 개선이 되었지만 효과가 없거나 악화된 경우도 있어 자세한
연구가 필요하고 다른 Cytokine을 표적으로 하는 여러 약물들(TNF-Blockers,
Infliximab, Etanercept, Adalimumab)도 효과가 일정치 않아 현재 적용하기가 힘든 상황이다. IFN-α를 표적으로 하는 Sifalimumab를 환자에게 투여하였더니 근육에 개선된 것을 확인할 수 있어 현재 임상 2상이 진행 중이다 (47-49).
b. Inclusion-Body Myositis (IBM)
IBM은 hIBM(GEN Myopathy)와
구분하기 위해서 Sporadic Inclusion Body Myositis(sIBM, 봉입체근염)이라고 불리기도 한다. 서양에서는 40대
이상에서 발병하는 근육 질환 중 가장 흔한 질환으로 알려져 있지만, 국내에서는 아직 확진된 사례가 거의
없는 근염이다. 유병률은 인종과 지역에 따라서 차이가 있다. 미국의
경우 1,000,000명 당 약 4.9명, 45세 이상에서는 1,000,000명 당 약 16명으로 보고되었다
병리학적 특징은 발병 초기부터 염증이 관찰되며, 질환이 일정 정도 진행된 이후에는 생검된 근육에서 액포(Vacuole)가
관찰된다는 것이다. 흥미로운 것은 이들 액포가 Ubiquitin-Positive
Multi-Protein Aggregate를 포함하고 있고, LC3 Positive한 Autophagic Vacuole이라는 것이다. 일부 보고에서는 응집된
단백질에는 Amyloid-Beta, Phosphorylated Tau, Alpha-Synuclein이
포함되어 있다고 한다 (52-54). 일부 연구에서 보여지는 결과에 따르면 IBM은 근육 특이적인 자가면역질환일 가능성을 시사하고 있다. 특히
Anti-NT5C1A Autoantibody와 관련된 보고는 자가면역 질환 가능성을 강력하게 뒷받침하고
있다 (55). 흥미롭게도 일본에서 이뤄진 연구에 의하면
일본에서 SIBM 환자가 급증하고 있다는 사실이 밝혀졌다(2003년
현재 1,000,000명당 9.83 케이스). 이는 수명의 증가와 과거에는 SIBM을 진단하는 리스트에 포함되지
않았을 가능성으로도 설명이 가능하지만, 서구화된 식습관의 영향이라고 주장하기도 한다. 이는 서구에는 상대적으로 흔한 질환이고 서구화된 식습관과 함께 일본에서도 환자가 증가하기 때문이라는 논리에
의한 설명이다. 다시 말하자면 아직까지 병인이 명확하지 않다는 것이다.
병인을 밝히기 위한 연구가 지속적으로 이뤄져야 할 것으로 보인다. 병인 정확하지 않기 때문에
동물(생쥐) 모델도 다양하지 않다. 현재까지 연구를 통해서 보고된 동물 모델은 Mutant Valosin-Containing
Protein(VCP) 생쥐(Transgenic), Fast-Twitch
골격근에
Beta-APP가 발현하는 생쥐, Autophagy Inhibitor인
Chloroquine 처리로 유도된 모델 등이 있다 (56-59).
현재 대증요법을 제외한 SIBM의 치료제는 없다. Phospho-Tau 생성에 관여하는 것으로
알려진 GSK의 활성을 저해하는 리튬을 이용한 전임상은 2009년부터
2010년 사이에 진행이 되었으나 효과가 관찰되지 않았다(NCT00917956).
IL1 Receptor Antagonist인 Anakinra에 대한 임상시험도 IBM과 Polymyositis, Dermatomyositis를 대상으로
2010년도에 수행되었으나 뚜렷한 효능을 확인하지 못했다(NCT01165008).
Heat Shock Protein 70(Hsp70)을 증가시켜 세포 내 여러 스트레스로부터 보호 기능을 하는 것으로 알려진 Arimoclomol을 이용한 임상시험(1상)에서 안정성과 약효의 가능성이 확인되었다. 현재 Inclusion Body Myositis Functional Rating Scale(IBMFRS) 감소와 대퇴근의
최대 자발적 정적 수축력(Maximum Voluntary Isometric Contraction, MVICT)의
개선 등을 목표로 임상 2상이 진행 중이다(NCT02753530). AAV를
이용한 Follistatin Gene Therapy의 임상시험(NCT01519349)도
의미 있는 결과를 얻은 것으로 보고되었다. 6분 보행검사(6-Min Walk
Test, 6MWT)에서 유의차를 보였고, 섬유화 감소와 근재생에도 효능을 관찰했다고 보고했다
(60). 가장 관심을 주목을 끌었던 임상시험은 Norvatis의 Bimagrumab이다. Bimagrumab은 Myostatin의 Receptor라고 할 수 있는 Activin Type II Receptor(ActRII)를
표적으로 하는 Monoclonal Antibody이며, Myostatin
신호 전달 과정을 막는다. 전임상 연구와 임상 2상
시험과는 다르게 임상 3상 시험에서 1차 유효성 평가 변수를
만족하지 못했다
c. GNE Myopathy (GM, Inclusion Body Myopathy
2, Nonaka Myopathy)
GM은 전 세계에서 드물게 발병하고 있으나, 현재까지 알려진 대부분의 환자는 일본인과 페르시안 유대계이다.
1,000,000명 중 약 1명 정도 발생하며, 일본과
중동에서 발병률이 상대적으로 높기는 하나, 전 세계적으로 발생하는 질환으로 알려져 있다
GNE 단백질은 UDP-GlcNAc 2-epimerase/ManNAc Kinase 활성을 가지고 있어, UDP-GLcNAc을 ManNac으로 전환하는 생화학 반응을 수행한다
(65). 이 효소는 Cell Signaling, Migration, Attaching 등에 관여하는 Sialic Acid 합성 경로의 중요 효소 중 하나이다. 이와 같은
기능에 이상이 생기면 몸 전체적으로 영향이 있을 것으로 예상되나 실제로는 골격근에만 영향을 주는 것으로 보여 자세한 원인은 여전히 연구가 필요하다
(63, 64). Gne Knock-out 생쥐 모델은 Embryonic Lethal을 보인다. NIH-USA Group에서
제작한 p.M743T Knock-in 생쥐 모델은 신장의 문제로 태어나서 72시간 만에 죽는 것으로 알려져 있다. 일본 Nishino 그룹의 Gne−/−hGNED176VL-Tg(사람의 GNE D176V Mutation을 가지고 있음) 생쥐 모델의 경우 20주령 이후부터 근육 위축을 보이며, 30주령 이후에는 Amyloid 축적이 관찰되고, 40주령 이후에는 Rimmed Vacuole이 관찰되는 것으로 알려져
있다. 이 생쥐 모델을 이용한 실험에서 N-Acetylneuraminic
Acid(NeuAc), ManNAc 또는 Sialylactose 투여가 생존율과 근기능
관련 표현형을 개선하는 것으로 보고되었다
진행을 막거나 완치할 수 있는 치료법은
현재 없다. 다른 근육 질환과 마찬가지로 물리치료 및 작업치료법 등으로 근력을 유지해주며 대증요법을
진행하고 있다. 현재 하루 12,000 mg/day의 N-acetyl-D-mannosamine
monohydrate(ManNAc)을 투여하는 임상시험이 진행 중이다 (NCT02346461,
Active, not recruiting). Aceneuramic Acid
Extended Release (Ace-ER, NCT02731690),
Sialic Acid-Extended Release (SA-ER, NCT01830972),
Intravenous Immune Globulin (IVIG, NCT00195637) 등의 임상시험은 중단되었거나
완료된 상황이다 (ClincalTrials.gov 참조).
3. 견해 및 논의
근육 질환의 현주소를 네 개의 단어로 표현한다면 “질환의 증가와 치료제 부재”이다. 대부분의 경우 대증요법과 물리치료/운동요법을 통한 근력 및 가동성 유지가 치료방법의 전부이다. 역설적이게도
돌연변이 된 원인 유전자가 밝혀진 유전성 근육 질환은 유전자 치료의 한계로 치료법이 없고, 성인기에
나타나는 일부 근육 질환은 유전성은 아닌 것으로 판단되지만 그 원인이 밝혀져 있지 않아 치료제가 없는 실정이다.
AAV 등을 이용한 유전자 치료(Gene Therapy), 근육줄기세포(Muscle Stem Cell) 등을 이용한 Cell Therapy 등을
이용한 연구가 진행되었지만 뚜렷한 효능을 보지 못하자 그 열기가 사그라지는 추세였다. 최근 CRIPSR-CAS9, Transcription Activator-Like Effector Nucleases(TALEN) 등과
같은 표적이 가능하고 정교하게 유전자 교정이 가능한 기술이 발전하면서 근육 질환과 같은 희귀 난치성 유전 질환을 대상으로 하는 유전자 치료의 새로운
붐이 도래할 것으로 예상된다. 실제로 국내 연구진에서 mdx 생쥐를 대상으로 AAV 벡터를 이용하여 성체에서 정상 Dmd 유전자 발현이 가능함을 보이기도 했다
기술적으로 변형된 CRISPR-CAS9가 전통적인 DNA Editing
외에도 응용될 수 있음이 최근 계속 보고되고 있다. FSHD의 경우 DUX4가 Toxin Gain-of-Function 형식의 질환 유발
인자로 추정될 뿐, 그 메커니즘이 정확하게 알려져 있는 것은 아니다.
따라서 DUX4를 표적으로 하는 것보다는 Hypomethylation이
일어난 염색체 상의 4q35를 표적으로 치료제를 개발하는 것이 더 가능성이 높아 보인다. 최근에 CAS9을 Epigenetic
Factor에 Fusion하고 표적 Guide RNA를
디자인하여 정확하게 목표 위치를 찾아 Chromatin Structure 조절에 성공했다는 연구가 발표되었다
(68). 따라서
SMCHD1, DNMT3B 또는 Histone Methyl Transferase를 CAS9과 융합/결합시키고 4q35를
표적으로 하는 Guide RNA를 만들어 4q35 부분의
Hypermethylation을 유도하는 방식의 치료법이 가능하리라 생각된다.
앞서 언급한 것처럼 일부 IBM 등과 같은 근육 질환의 경우는 원인 인자가 정확하게 밝혀져
있지 않다. 유전성 근육 질환의 경우 변형된 유전자 또는 염색체 상의 위치가 알려져 있음에도 어떠한
세포 내외부의 요소들이 관여하여 질환을 유발하고 악화시키는지 관해서 기대보다 연구가 많이 이뤄져 있지 않다고 해도 과언은 아니다. 필자의 연구팀은 Gene Expression Omnibus(GEO, www.ncbi.nlm.nih.gov/geo/)
데이터베이스에서 13개의 다른 근육 질환자에서 유래된 전사체(Transcriptome)를 Gene-set Enrichment Analysis
도구를 이용하여 분석해보았다. 흥미로운 것은 발병 요인이 다른 근육 질환에서 공통적으로
Mitochondria, Autophagy, Proteostasis, NAD+ Metabolism
등에 관련된 유전자 세트의 이상(발현 감소)을
보인다는 것이다. 최근 연구에서 Mitochondria 관련
유전자 발현에 역할을 하는 SIRTUIN 단백질의 활성에 직접 관여하고, 근육 질환을 포함한 다양한 질환 및 노화에서 감소된 것으로 알려진 세포 내부의 NAD+ 레벨을 상승하게 하는 일명 NAD+
Booster가 근육 질환의 증상을 완화할 수 있는 것이 보여졌다 (12). 또한 Mitochondria
유전자 발현에 직접 관여하는 전사 인자 PPARδ Agonist도
그 가능성이 임상시험에서 평가 중에 있다. 따라서 최근 급격하게 발달하고 있는 OMICS 도구를 활용하여 유전체, 전사체, 단백체, 대사체 등의 분석으로부터 숨겨진 병인을 찾는 노력이 치료제와
치료법 개발에 새로운 출발점이 될 것이다.
참고문헌
1. Emery,
A. E. (1991) Population frequencies of inherited neuromuscular diseases--a
world survey. Neuromuscul Disord 1, 19-29.
2. Bakker, E., Van Broeckhoven,
C., Bonten, E. J., van de Vooren, M. J., Veenema, H., Van Hul, W., Van Ommen,
G. J., Vandenberghe, A. and Pearson, P. L. (1987) Germline mosaicism and
Duchenne muscular dystrophy mutations. Nature
329, 554-556.
3. Flanigan, K. M. (2014) Duchenne
and Becker muscular dystrophies. Neurol
Clin 32, 671-688, viii.
4. Emery, A. E. (2002) The
muscular dystrophies. Lancet 359, 687-695.
5. Ono, Y., Saido, T. C. and
Sorimachi, H. (2016) Calpain research for drug discovery: challenges and
potential. Nat Rev Drug Discov 15, 854-876.
6. Badalamente, M. A. and
Stracher, A. (2000) Delay of muscle degeneration and necrosis in mdx mice by
calpain inhibition. Muscle Nerve 23, 106-111.
7. Childers, M. K., Bogan, J. R.,
Bogan, D. J., Greiner, H., Holder, M., Grange, R. W. and Kornegay, J. N. (2011)
Chronic administration of a leupeptin-derived calpain inhibitor fails to ameliorate
severe muscle pathology in a canine model of duchenne muscular dystrophy. Front Pharmacol 2, 89.
8. Selsby, J., Pendrak, K., Zadel,
M., Tian, Z., Pham, J., Carver, T., Acosta, P., Barton, E. and Sweeney, H. L.
(2010) Leupeptin-based inhibitors do not improve the mdx phenotype. Am J Physiol Regul Integr Comp Physiol 299, R1192-1201.
9. Imura, A., Tsuji, Y., Murata,
M., Maeda, R., Kubota, K., Iwano, A., Obuse, C., Togashi, K., Tominaga, M.,
Kita, N., Tomiyama, K., Iijima, J., Nabeshima, Y., Fujioka, M., Asato, R.,
Tanaka, S., Kojima, K., Ito, J., Nozaki, K., Hashimoto, N., Ito, T., Nishio,
T., Uchiyama, T., Fujimori, T. and Nabeshima, Y. (2007) alpha-Klotho as a
regulator of calcium homeostasis. Science
316, 1615-1618.
10. Wehling-Henricks, M., Li, Z.,
Lindsey, C., Wang, Y., Welc, S. S., Ramos, J. N., Khanlou, N., Kuro, O. M. and
Tidball, J. G. (2016) Klotho gene silencing promotes pathology in the mdx mouse
model of Duchenne muscular dystrophy. Hum
Mol Genet 25, 2465-2482.
11. De Luca, A. (2012) Pre-clinical
drug tests in the mdx mouse as a model of dystrophinopathies: an overview. Acta Myol 31, 40-47.
12. Ryu, D., Zhang, H., Ropelle, E.
R., Sorrentino, V., Mazala, D. A., Mouchiroud, L., Marshall, P. L., Campbell,
M. D., Ali, A. S., Knowels, G. M., Bellemin, S., Iyer, S. R., Wang, X.,
Gariani, K., Sauve, A. A., Canto, C., Conley, K. E., Walter, L., Lovering, R.
M., Chin, E. R., Jasmin, B. J., Marcinek, D. J., Menzies, K. J. and Auwerx, J.
(2016) NAD+ repletion improves muscle function in muscular dystrophy and
counters global PARylation. Sci Transl
Med 8, 361ra139.
13. Aartsma-Rus, A. and Krieg, A.
M. (2017) FDA Approves Eteplirsen for Duchenne Muscular Dystrophy: The Next
Chapter in the Eteplirsen Saga. Nucleic
Acid Ther 27, 1-3.
14. Sheridan, C. (2016) Duchenne
muscular dystrophy drugs at the crossroads, as newer agents advance. Nat Biotechnol 34, 675-676.
15. Bell, E. L., Shine, R. W.,
Dwyer, P., Olson, L., Truong, J., Fredenburg, R., Goddeeris, M., Stickens, D.
and Tozzo, E. (2018) PPARdelta modulation rescues mitochondrial fatty acid
oxidation defects in the mdx model of muscular dystrophy. Mitochondrion.
16. Bird, T. D. (1993) Myotonic
Dystrophy Type 1; in: GeneReviews((R)).
Adam, M. P., Ardinger, H. H., Pagon, R. A., Wallace, S. E., Bean, L. J. H.,
Stephens, K. and Amemiya, A. (eds.), Seattle (WA).
17. Ashizawa, T. and Sarkar, P. S.
(2011) Myotonic dystrophy types 1 and 2. Handb
Clin Neurol 101, 193-237.
18. Mathieu, J., De Braekeleer, M.
and Prevost, C. (1990) Genealogical reconstruction of myotonic dystrophy in the
Saguenay-Lac-Saint-Jean area (Quebec, Canada). Neurology 40, 839-842.
19. Hannan, A. J. (2018) Tandem
repeats mediating genetic plasticity in health and disease. Nat Rev Genet 19, 286-298.
20. Klesert, T. R., Otten, A. D.,
Bird, T. D. and Tapscott, S. J. (1997) Trinucleotide repeat expansion at the
myotonic dystrophy locus reduces expression of DMAHP. Nat Genet 16, 402-406.
21. Timchenko, L. T., Miller, J.
W., Timchenko, N. A., DeVore, D. R., Datar, K. V., Lin, L., Roberts, R.,
Caskey, C. T. and Swanson, M. S. (1996) Identification of a (CUG)n triplet
repeat RNA-binding protein and its expression in myotonic dystrophy. Nucleic Acids Res 24, 4407-4414.
22. Jansen, G., Groenen, P. J.,
Bachner, D., Jap, P. H., Coerwinkel, M., Oerlemans, F., van den Broek, W.,
Gohlsch, B., Pette, D., Plomp, J. J., Molenaar, P. C., Nederhoff, M. G., van
Echteld, C. J., Dekker, M., Berns, A., Hameister, H. and Wieringa, B. (1996)
Abnormal myotonic dystrophy protein kinase levels produce only mild myopathy in
mice. Nat Genet 13, 316-324.
23. Liquori, C. L., Ricker, K.,
Moseley, M. L., Jacobsen, J. F., Kress, W., Naylor, S. L., Day, J. W. and
Ranum, L. P. (2001) Myotonic dystrophy type 2 caused by a CCTG expansion in
intron 1 of ZNF9. Science 293, 864-867.
24. Heatwole, C., Johnson, N.,
Goldberg, B., Martens, W. and Moxley, R., 3rd (2011) Laboratory abnormalities
in patients with myotonic dystrophy type 2. Arch
Neurol 68, 1180-1184.
25. Wheeler, T. M., Leger, A. J.,
Pandey, S. K., MacLeod, A. R., Nakamori, M., Cheng, S. H., Wentworth, B. M.,
Bennett, C. F. and Thornton, C. A. (2012) Targeting nuclear RNA for in vivo
correction of myotonic dystrophy. Nature
488, 111-115.
26. Mullard, A. (2017) Small
molecules against RNA targets attract big backers. Nat Rev Drug Discov 16,
813-815.
27. Lemmers, R., Miller, D. G. and
van der Maarel, S. M. (1993) Facioscapulohumeral Muscular Dystrophy; in: GeneReviews((R)). Adam, M. P., Ardinger,
H. H., Pagon, R. A., Wallace, S. E., Bean, L. J. H., Stephens, K. and Amemiya,
A. (eds.), Seattle (WA).
28. Statland, J. and Tawil, R.
(2014) Facioscapulohumeral muscular dystrophy. Neurol Clin 32, 721-728,
ix.
29. Sacconi, S., Salviati, L. and
Desnuelle, C. (2015) Facioscapulohumeral muscular dystrophy. Biochim Biophys Acta 1852, 607-614.
30. Lek, A., Rahimov, F., Jones, P.
L. and Kunkel, L. M. (2015) Emerging preclinical animal models for FSHD. Trends Mol Med 21, 295-306.
31. Chen, J. C., King, O. D.,
Zhang, Y., Clayton, N. P., Spencer, C., Wentworth, B. M., Emerson, C. P., Jr.
and Wagner, K. R. (2016) Morpholino-mediated Knockdown of DUX4 Toward
Facioscapulohumeral Muscular Dystrophy Therapeutics. Mol Ther 24, 1405-1411.
32. Aoki, M. (1993)
Dysferlinopathy; in: GeneReviews((R)).
Adam, M. P., Ardinger, H. H., Pagon, R. A., Wallace, S. E., Bean, L. J. H.,
Stephens, K. and Amemiya, A. (eds.), Seattle (WA).
33. Liu, J., Aoki, M., Illa, I.,
Wu, C., Fardeau, M., Angelini, C., Serrano, C., Urtizberea, J. A., Hentati, F.,
Hamida, M. B., Bohlega, S., Culper, E. J., Amato, A. A., Bossie, K., Oeltjen,
J., Bejaoui, K., McKenna-Yasek, D., Hosler, B. A., Schurr, E., Arahata, K., de
Jong, P. J. and Brown, R. H., Jr. (1998) Dysferlin, a novel skeletal muscle
gene, is mutated in Miyoshi myopathy and limb girdle muscular dystrophy. Nat Genet 20, 31-36.
34. Yildiz, H., Emre, U., Coskun,
O., Ergun, U., Atasoy, H. T. and Inan, L. E. (2003) Distal muscular dystrophy
of the Miyoshi type. Clin Neuropathol
22, 204-208.
35. Cardenas, A. M.,
Gonzalez-Jamett, A. M., Cea, L. A., Bevilacqua, J. A. and Caviedes, P. (2016)
Dysferlin function in skeletal muscle: Possible pathological mechanisms and
therapeutical targets in dysferlinopathies. Exp
Neurol 283, 246-254.
36. Middel, V., Zhou, L., Takamiya,
M., Beil, T., Shahid, M., Roostalu, U., Grabher, C., Rastegar, S., Reischl, M.,
Nienhaus, G. U. and Strahle, U. (2016) Dysferlin-mediated phosphatidylserine
sorting engages macrophages in sarcolemma repair. Nat Commun 7, 12875.
37. Norwood, F. L., Harling, C.,
Chinnery, P. F., Eagle, M., Bushby, K. and Straub, V. (2009) Prevalence of
genetic muscle disease in Northern England: in-depth analysis of a muscle
clinic population. Brain 132, 3175-3186.
38. Laing, N. G., Laing, B. A.,
Meredith, C., Wilton, S. D., Robbins, P., Honeyman, K., Dorosz, S., Kozman, H.,
Mastaglia, F. L. and Kakulas, B. A. (1995) Autosomal dominant distal myopathy:
linkage to chromosome 14. Am J Hum Genet
56, 422-427.
39. Darin, N., Tajsharghi, H.,
Ostman-Smith, I., Gilljam, T. and Oldfors, A. (2007) New skeletal myopathy and
cardiomyopathy associated with a missense mutation in MYH7. Neurology 68, 2041-2042.
40. Hornsey, M. A., Laval, S. H.,
Barresi, R., Lochmuller, H. and Bushby, K. (2013) Muscular dystrophy in dysferlin-deficient
mouse models. Neuromuscul Disord 23, 377-387.
41. Cox, S., Limaye, V., Hill, C.,
Blumbergs, P. and Roberts-Thomson, P. (2010) Idiopathic inflammatory
myopathies: diagnostic criteria, classification and epidemiological features. Int J Rheum Dis 13, 117-124.
42. Gourley, M. and Miller, F. W.
(2007) Mechanisms of disease: Environmental factors in the pathogenesis of
rheumatic disease. Nat Clin Pract
Rheumatol 3, 172-180.
43. Coley, W., Rayavarapu, S.,
Pandey, G. S., Sabina, R. L., Van der Meulen, J. H., Ampong, B., Wortmann, R.
L., Rawat, R. and Nagaraju, K. (2012) The molecular basis of skeletal muscle
weakness in a mouse model of inflammatory myopathy. Arthritis Rheum 64,
3750-3759.
44. Rider, L. G., Lachenbruch, P.
A., Monroe, J. B., Ravelli, A., Cabalar, I., Feldman, B. M., Villalba, M. L.,
Myones, B. L., Pachman, L. M., Rennebohm, R. M., Reed, A. M., Miller, F. W. and
Group, I. (2009) Damage extent and predictors in adult and juvenile
dermatomyositis and polymyositis as determined with the myositis damage index. Arthritis Rheum 60, 3425-3435.
45. Leclair, V. and Lundberg, I. E.
(2018) New Myositis Classification Criteria-What We Have Learned Since Bohan
and Peter. Curr Rheumatol Rep 20, 18.
46. Dalakas, M. C. (2012)
Pathogenesis and therapies of immune-mediated myopathies. Autoimmun Rev 11,
203-206.
47. Higgs, B. W., Zhu, W.,
Morehouse, C., White, W. I., Brohawn, P., Guo, X., Rebelatto, M., Le, C.,
Amato, A., Fiorentino, D., Greenberg, S. A., Drappa, J., Richman, L., Greth,
W., Jallal, B. and Yao, Y. (2014) A phase 1b clinical trial evaluating
sifalimumab, an anti-IFN-alpha monoclonal antibody, shows target neutralisation
of a type I IFN signature in blood of dermatomyositis and polymyositis
patients. Ann Rheum Dis 73, 256-262.
48. Muscle Study, G. (2011) A
randomized, pilot trial of etanercept in dermatomyositis. Ann Neurol 70, 427-436.
49. Tjarnlund, A., Tang, Q., Wick,
C., Dastmalchi, M., Mann, H., Tomasova Studynkova, J., Chura, R., Gullick, N.
J., Salerno, R., Ronnelid, J., Alexanderson, H., Lindroos, E., Aggarwal, R.,
Gordon, P., Vencovsky, J. and Lundberg, I. E. (2018) Abatacept in the treatment
of adult dermatomyositis and polymyositis: a randomised, phase IIb treatment
delayed-start trial. Ann Rheum Dis 77, 55-62.
50. Mastaglia, F. L. (2009)
Sporadic inclusion body myositis: variability in prevalence and phenotype and
influence of the MHC. Acta Myol 28, 66-71.
51. Keller, C. W., Schmidt, J. and
Lunemann, J. D. (2017) Immune and myodegenerative pathomechanisms in inclusion
body myositis. Ann Clin Transl Neurol
4, 422-445.
52. Askanas, V. and Engel, W. K.
(2008) Inclusion-body myositis: muscle-fiber molecular pathology and possible
pathogenic significance of its similarity to Alzheimer's and Parkinson's
disease brains. Acta Neuropathol 116, 583-595.
53. Askanas, V., Engel, W. K. and
Nogalska, A. (2009) Inclusion body myositis: a degenerative muscle disease
associated with intra-muscle fiber multi-protein aggregates, proteasome
inhibition, endoplasmic reticulum stress and decreased lysosomal degradation. Brain Pathol 19, 493-506.
54. Nogalska, A., D'Agostino, C.,
Terracciano, C., Engel, W. K. and Askanas, V. (2010) Impaired autophagy in
sporadic inclusion-body myositis and in endoplasmic reticulum stress-provoked
cultured human muscle fibers. Am J Pathol
177, 1377-1387.
55. Pluk, H., van Hoeve, B. J., van
Dooren, S. H., Stammen-Vogelzangs, J., van der Heijden, A., Schelhaas, H. J.,
Verbeek, M. M., Badrising, U. A., Arnardottir, S., Gheorghe, K., Lundberg, I.
E., Boelens, W. C., van Engelen, B. G. and Pruijn, G. J. (2013) Autoantibodies
to cytosolic 5'-nucleotidase 1A in inclusion body myositis. Ann Neurol 73, 397-407.
56. Ahmed, M., Machado, P. M.,
Miller, A., Spicer, C., Herbelin, L., He, J., Noel, J., Wang, Y., McVey, A. L.,
Pasnoor, M., Gallagher, P., Statland, J., Lu, C. H., Kalmar, B., Brady, S.,
Sethi, H., Samandouras, G., Parton, M., Holton, J. L., Weston, A., Collinson,
L., Taylor, J. P., Schiavo, G., Hanna, M. G., Barohn, R. J., Dimachkie, M. M.
and Greensmith, L. (2016) Targeting protein homeostasis in sporadic inclusion
body myositis. Sci Transl Med 8, 331ra341.
57. Moussa, C. E., Fu, Q., Kumar,
P., Shtifman, A., Lopez, J. R., Allen, P. D., LaFerla, F., Weinberg, D.,
Magrane, J., Aprahamian, T., Walsh, K., Rosen, K. M. and Querfurth, H. W.
(2006) Transgenic expression of beta-APP in fast-twitch skeletal muscle leads
to calcium dyshomeostasis and IBM-like pathology. FASEB J 20, 2165-2167.
58. Askanas, V., Engel, W. K. and
Nogalska, A. (2012) Pathogenic considerations in sporadic inclusion-body
myositis, a degenerative muscle disease associated with aging and abnormalities
of myoproteostasis. J Neuropathol Exp
Neurol 71, 680-693.
59. Sugarman, M. C., Yamasaki, T.
R., Oddo, S., Echegoyen, J. C., Murphy, M. P., Golde, T. E., Jannatipour, M., Leissring,
M. A. and LaFerla, F. M. (2002) Inclusion body myositis-like phenotype induced
by transgenic overexpression of beta APP in skeletal muscle. Proc Natl Acad Sci U S A 99, 6334-6339.
60. Mendell, J. R., Sahenk, Z.,
Al-Zaidy, S., Rodino-Klapac, L. R., Lowes, L. P., Alfano, L. N., Berry, K.,
Miller, N., Yalvac, M., Dvorchik, I., Moore-Clingenpeel, M., Flanigan, K. M.,
Church, K., Shontz, K., Curry, C., Lewis, S., McColly, M., Hogan, M. J. and
Kaspar, B. K. (2017) Follistatin Gene Therapy for Sporadic Inclusion Body
Myositis Improves Functional Outcomes. Mol
Ther 25, 870-879.
61. Garber, K. (2016) No longer
going to waste. Nat Biotechnol 34, 458-461.
62. Nishino, I., Carrillo-Carrasco,
N. and Argov, Z. (2015) GNE myopathy: current update and future therapy. J Neurol Neurosurg Psychiatry 86, 385-392.
63. Kayashima, T., Matsuo, H.,
Satoh, A., Ohta, T., Yoshiura, K., Matsumoto, N., Nakane, Y., Niikawa, N. and
Kishino, T. (2002) Nonaka myopathy is caused by mutations in the
UDP-N-acetylglucosamine-2-epimerase/N-acetylmannosamine kinase gene (GNE). J Hum Genet 47, 77-79.
64. Malicdan, M. C., Noguchi, S.
and Nishino, I. (2008) Recent advances in distal myopathy with rimmed vacuoles
(DMRV) or hIBM: treatment perspectives. Curr
Opin Neurol 21, 596-600.
65. Huizing, M., Carrillo-Carrasco,
N., Malicdan, M. C., Noguchi, S., Gahl, W. A., Mitrani-Rosenbaum, S., Argov, Z.
and Nishino, I. (2014) GNE myopathy: new name and new mutation nomenclature. Neuromuscul Disord 24, 387-389.
66. Malicdan, M. C., Noguchi, S.,
Hayashi, Y. K., Nonaka, I. and Nishino, I. (2009) Prophylactic treatment with
sialic acid metabolites precludes the development of the myopathic phenotype in
the DMRV-hIBM mouse model. Nat Med 15, 690-695.
67. Ryu, S. M., Koo, T., Kim, K.,
Lim, K., Baek, G., Kim, S. T., Kim, H. S., Kim, D. E., Lee, H., Chung, E. and
Kim, J. S. (2018) Adenine base editing in mouse embryos and an adult mouse
model of Duchenne muscular dystrophy. Nat
Biotechnol 36, 536-539.
68. Hilton, I. B.,
D'Ippolito, A. M., Vockley, C. M., Thakore, P. I., Crawford, G. E., Reddy, T.
E. and Gersbach, C. A. (2015) Epigenome editing by a CRISPR-Cas9-based
acetyltransferase activates genes from promoters and enhancers. Nat Biotechnol 33, 510-517.
첨부파일