
생화학분자생물학회입니다.
보체 C1q에 특이적으로 결합하는 IgG의 Fc Domain을 통한 보체 매개 면역 반응의 중요성 연구
작성자
관리자작성일자
2018-08-01조회수
1217IgG Fc domains that bind C1q but not effector Fcγ receptors delineate the importance of complement-mediated effector functions

이창한
University of Texas at Austin
연구배경
Immunoglobulin G(IgG)의 Fc Domain은 다양한 Fc Receptor를 가지고 있으며, 항체가 병원체와 Immune Complex(IC)를 형성 후 Fc Receptor를 통해 보체(Complement)와 면역 세포(Immune Cells)들을 활성화시켜 병원체를 제거하게 된다. 이러한 기능은 표적 병원체의 중화 및 제거와 적응 면역 프로그래밍(Adaptive Immune Response)을 직접 또는 간접적으로 매개한다 (1). Effector Function은 면역 글로불린 G(IgG)의 Fc 도메인과 다양한 백혈구 서브 세트에서 발현되는 Fcγ 수용체(FcγR)의 결합 및 보체 성분 C1q의 결합 및 고전적인 보체 경로(Classical Complement Cascade)의 활성화로부터 발생한다. 면역 복합체(Immune Complex, IC)를 통한 FcγR의 활성화는 항체 의존성 세포 매개 세포 독성(Antibody-Dependent Cellular Cytotoxicity, ADCC) 및 항체 의존성 세포 매개 식균 작용(Antibody-Dependent Cellular Phagocytosis, ADCP)의 원인이 되며, 많은 치료 항체의 주요 작용 기작이다 (그림 1). 대안으로, 고전적인 보체 경로의 활성화는 두 개의 별개의 과정에 의해 나타난다. 첫째, 세포막으로의 막 공격 복합체(Membrane Attacking Complex, MAC) 삽입(Complement Dependent Cytotoxicity, CDC)으로 인한 직접 세포 용해 기작과, 두 번째, C3b와 같은 Opsonin이 세포 표면에 공유 결합되어 차례로 Effector Cell의 보체 수용체(CRs)에 의해 인식된다. 침착된 Opsonin에 의해 활성화된 CR은 보체 의존성 세포 매개 세포 독성(CDCC) 및 보체 의존성 세포 매개 식균 작용 (CDCP)을 유발한다 (2).
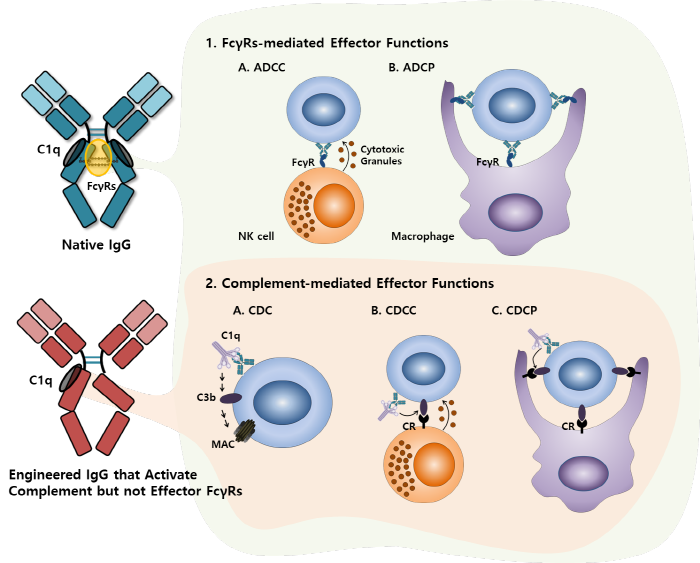
그림 1. IgG 매개 Effector Functions
1. C1q 특이적인 결합능을 가지는 Fc Domain 개발
|
KD (nM) | ||||||||
|
Antibody |
C1q |
Monomeric FcγRIa |
Dimeric FcγRIIaH131 |
Dimeric FcγRIIaR131 |
Dimeric FcγRIIb |
Dimeric FcγRIIIaV158 |
Dimeric FcγRIIIaF158 |
FcRn |
|
IgG1 |
23.0 |
1.5 |
120 |
310 |
1300 |
195 |
390 |
623 |
|
A801 |
0.108 |
n.b. |
n.b. |
n.b. |
n.b. |
n.b. |
n.b. |
959 |
표 1. A801 항체의 Fc Receptor에 대한 친화도
2. CR 매개 암세포 사멸 기작 분석
CDCC의 작용이 일어나기 위해서는 Complement의 소스인 Serum과 Effector Cell이 필요하다. 또한 Effector Cell은 FcγR와 CR을 모두 발현하고 있기 때문에 Serum과 Effector Cell이 같이 존재하는 조건에서 야생형 항체에 의해서는 CDC, CDCC(P), ADCC(P)가 모두 작용하기 때문에 지금까지 CDCC(P)를 분석하지 못하였다. 이에 반해 A801-Fc가 FcγR에 결합하지 않고 C1q에만 결합능을 지니고 있기 때문에 FcγR에 의한 Effector Function인 ADCC(P)를 유도하지 않고 같은 조건 하에서 CDC와 CDCC(P)만을 유도할 수 있다 (표 2).
|
Possible Effector Functions | |||
|
Serum |
Immune cells |
Wild type IgG |
A801 IgG |
|
PHS |
None |
CDC |
CDC |
|
None |
PBMC (or PMN) |
ADCC |
None |
|
Macrophage |
ADCP |
None | |
|
C9-depleted serum * |
PBMC (or PMN) |
ADCC + CDCC |
CDCC |
|
Macrophage |
ADCP + CDCP |
CDCP | |
|
PHS |
PBMC (or PMN) |
ADCC + CDC + CDCC |
CMC (CDC + CDCC) |
표 2. 실험 조건에 따른 Effector Function
이를 검증하기 위해 먼저 Serum이 없는 조건 하에서 A801 항체가 ADCC(P) 활성을 가지고 있지 않음을 확인하였다. 또한 CDC와 CDCC(P)를 구분하기 위해 CDC에서는 필수적이지만 CDCC(P)에 관여하지 않는 보체 단백질인 C9을 제거한 C9-Depleted Serum을 사용하였다. 그 결과 C9-Depleted Serum만 있을 경우 A801 항체는 암세포 사멸을 유도하지 못했지만 C9-Depleted Serum과 Effector Cell의 존재 하에서 암세포 사멸을 유도하였다. 즉, A801이 CDCC만으로 암세포 사멸을 유도할 수 있음을 보여주는 결과라 할 수 있다. 또한 야생형 항체는 ADCC와 CDCC의 세포 사멸 기전을 통해 표적 세포 사멸을 시켰지만 A801의 CDCC 활성과 동등하거나 좀더 약한 암세포 독성을 보여주었다. CDCC를 측정한 방법과 유사하게 C9-Depleted Serum과 M1-Macrophage의 존재 하에서 A801에 의한 Phagocytosis 활성을 측정하였다. 이에 앞서 Serum이 없는 경우 A801 항체가 ADCP 활성이 없었지만 C9-Depeleted Serum에서 보체를 통해 대식 세포에 의한 식균 작용을 효과적으로 수행하였다. 보체가 존재하는 조건에서만 A801 항체에 의한 식균 작용이 일어난다는 발견은 이것이 보체 침착에 의해 매개된다는 것을 명백하게 보여주는 결과이다 (표 3).(4).
|
|
|
ADCC |
ADCP |
CDCC (or ADCC+CDCC) |
CDCP (or ADCP+CDCP) | ||
|
Condition |
Serum |
- |
- |
- |
C9-depleted PHS | ||
|
Effector cell |
PBMC |
PMN |
Macrophage |
PBMC |
PMN |
Macrophage | |
|
EC50 (nM) in Raji cell |
Isotype control |
| |||||
|
WT IgG |
9.5±0.4 |
11.6±0.8 |
0.04±0.005 |
2.5±0.1 |
1.9±0.1 |
17.4±0.2 | |
|
A801 |
- |
- |
2.6±0.2 |
2.1±02. |
3.7±0.04 | ||
표 3. 각 Effector Function에 따른 각 항체의 EC50 Values
3. 마우스 모델에서 보체에 의한 항암 효과
A801의 암세포 사멸능을 마우스 모델에서 검증하였다. 우리는 흉선과 성숙한 T 세포가 없지만 대식세포와 NK 세포를 생산하는 이종 교잡한 누드 마우스에서 암세포에 의해 형성된 종양의 치료에서 A801의 항 종양 효과를 평가했다. 리툭산(Rituxan)에 의해 인간 CD20 (EL4-hCD20 세포)을 발현하는 EL4 마우스 림프종 세포의 제거는 일부 연구자들에 의해 FcγRs에 완전히 의존하는 것으로 보고되었지만, 다른 연구에서는 보체 단독 또는 보체와 FcγR 둘 모두가 중요하다는 것을 발견했다. 이는 종양 세포의 크기와 위치에 따라 달라진다. 우리는 추가적인 두 가지 마우스 모델을 통해 이를 검증하였다. 첫 번째, 전사 인자 Foxn1 (NMRI-Foxn1-/- Mice)이 결핍된 NMRI 누드 마우스에서 A801시 야생형 항체 그룹과 종양 성장 측면에서 유의한 차이가 없었으며 각 항체는 대조군보다 효과적이었다 (그림 2). 두 번째, 모든 이펙터 IgG 수용체 (Fcgr1, Fcgr2b, Fcgr3 및 Fcgr4; 여기서는 'FcγR-null'로 불림)를 코딩하는 유전자가 결여된 NMRI-Foxn1-/- 마우스에서는 야생형 항체의 항-종양 효과는 없어졌다 (그림 2). 이는 일반적으로 보체 활성이 약한 마우스에서 FcγR-매개 Effector Function 없이 보체 활성화만으로는 종양 성장을 지연시키기에 충분하지 않았기 때문이다. 대조적으로 A801 항체는 FcγR- 결실 마우스에서도 종양 성장을 지연시키는데 유의한 효과를 나타냈다 (그림 2).
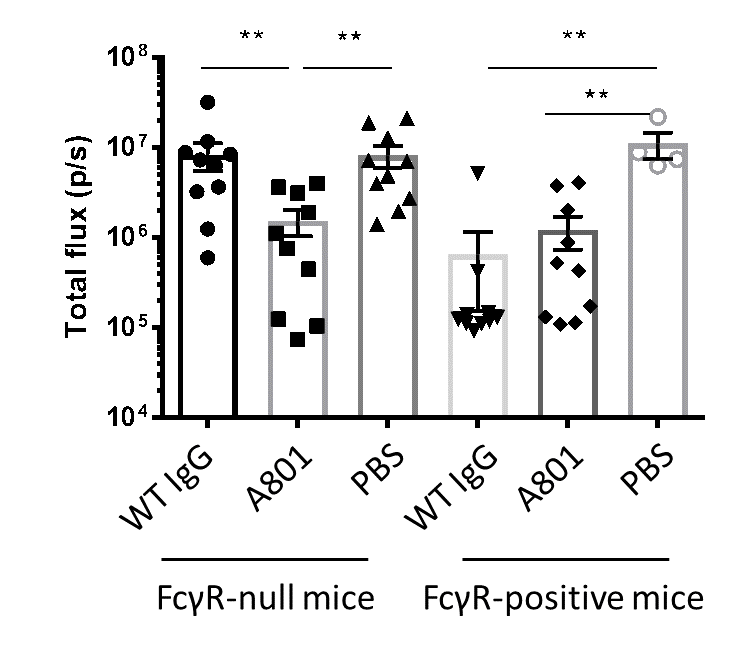
그림 2. A801 항체의 항-종양 효과 측정. 항체 치료 10일 후의 종양 크기 비교
연구 성과 및 의의
이펙터 세포는 FcγR 및 CR 모두를 발현한다. 따라서 혈청 존재 하에서 ADCC(또는 ADCP)와 CDCC(또는 CDCP)가 동시에 발생한다 (그림 1). 혈청이나 C1q가 없는 배지를 사용할 경우 쉽게 ADCC와 ADCP를 CDCC/CDCP 없이 분석할 수 있지만 그 반대는 그렇지 않다. ADCC 또는 ADCP 없이 CDCC 또는 CDCP만을 분석하기 위해서는 이펙터 세포에 의해 발현된 다수의 FcγR에 대한 IC의 결합을 차단할 필요가 있다. 우리는 CDCC와 CDCP의 연구를 위해 훨씬 더 다루기 쉬운 접근법이 FcγR에 관여하지 않고 C1q에만 결합해 보체를 활성화시킬 수 있는 인간 IgG1 Fc 도메인을 개발하는 것이라고 추론했다. IgG와 FcγR 사이의 매우 낮은 친화성조차도 Effector 표현형을 유발할 수 있기 때문에 이러한 목적으로 FcγR 결합을 '조용히 하는' 것이 중요하다. 절대 또는 거의 절대적인 C1q 선택성을 갖는 A801-Fc를 찾았으며 두 개의 Mutation을 가지고 있었다. 이 중 Cγ2의 K320E는 C1q 대한 실질적인 친화도를 부여하였고 Q386R은 Cγ3는 FcγR에 대한 어떠한 결합도 없애는 급격한 구조 변화를 만들었다.
우리는 항체에 의한 고전 보체 경로의 활성화에 의해 유발된 암세포 제거 메커니즘이 매우 광범위하고 신속하게 표적 세포 용해(CDCC) 및 식균 작용(CDCP)를 일으킬 수 있음을 보여주었다. 결과적으로 CDCC와 CDCP는 mAb의 작용 기작에 대한 연구에서 신중한 고려와 최적화가 필요하다.
하지만 CDCC와 CDCP의 상대적 중요성은 아마도 목표와 질병 설정에 크게 의존할 것이다. 첫째, 보체의 최적 활성화는 표적 세포 표면의 항원 밀도와 조직에 크게 의존한다. 둘째, 많은 병원성 세포가 보체 억제 단백질을 발현하며 이러한 경우에는 고전 경로의 활성화가 손상된다는 사실이 밝혀졌다 (7). 셋째, 표적 세포 및 항체에 의한 보체의 생체 내 광범위한 활성화는 C2와 C1q 또는 다른 보체 성분의 빠른 고갈로 이어진다는 것이 잘 알려져 있다 (8). 이러한 상황에서는 분명히 ADCC와 ADCP가 아마도 주요 항체 효과 기전일 것이다. 하지만 C1q 결합 선택성이 절대적인 단일 클론 항체는 FcγR 의존성 부작용을 회피하면서 특정 질병 상태에서 병원성 세포를 박멸하고 낮은 친화성 FcγR를 가지는 환자에서 유용할 수 있다 (9).
참고문헌
1. Nimmerjahn, F., J. V. Ravetch (2012) Translating basic mechanisms of IgG effector activity into next generation cancer therapies. Cancer Immun 12, 13.
2. Ricklin, D., G. Hajishengallis, K. Yang, J. D. Lambris (2010) Complement: a key system for immune surveillance and homeostasis. Nat Immunol 11, 785–797.
3. Sondermann, P., D. E. Szymkowski (2016) Harnessing Fc receptor biology in the design of therapeutic antibodies. Curr Opin Immunol 40, 78–87.
4. Vafa, O., G. L. Gilliland, R. J. Brezski, B. Strake, T. Wilkinson, E. R. Lacy, B. Scallon, A. Teplyakov, T. J. Malia, W. R. Strohl (2014) An engineered Fc variant of an IgG eliminates all immune effector functions via structural perturbations. Methods San Diego Calif 65, 114–126.
5. Schreiber, A. D., M. M. Frank (1972) Role of antibody and complement in the immune clearance and destruction of erythrocytes. II. Molecular nature of IgG and IgM complement-fixing sites and effects of their interaction with serum. J Clin Invest 51, 583–589.
6. Ackerman, M., F. Nimmerjahn (2013) Antibody Fc: Linking Adaptive and Innate Immunity. Academic Press
7. Taylor, R. P., M. A. Lindorfer (2014). The role of complement in mAb-based therapies of cancer. Methods San Diego Calif 65, 18–27.
8. Kennedy, A. D., P. V. Beum, M. D. Solga, D. J. DiLillo, M. A. Lindorfer, C. E. Hess, J. J. Densmore, M. E. Williams, R. P. Taylor (2004) Rituximab infusion promotes rapid complement depletion and acute CD20 loss in chronic lymphocytic leukemia. J Immunol 172, 3280–3288.
9. Cartron, G., L. Dacheux, G. Salles, P. Solal-Celigny, P. Bardos, P. Colombat, H. Watier (2002) Therapeutic activity of humanized anti-CD20 monoclonal antibody and polymorphism in IgG Fc receptor FcgammaRIIIa gene. Blood 99, 754–758.
첨부파일