
생화학분자생물학회입니다.
Laboratory of Cancer Precision Medicine
작성자
관리자작성일자
2018-08-01조회수
1100
심중섭
[연구실 소개]
본 연구실은 마카오대학교의 건강과학부에 소속되어 있으며 현재 5명의 박사과정 학생과 1명의 연구원 및 1명의 학부생으로 이루어져 있다. 본 연구실에서는 Synthetic Lethality를 이용해 종양억제유전자(Tumor Suppressor)가 변이된 암세포를 선택적으로 제거하는 연구를 수행하고 있다. Synthetic Lethality는 암세포가 가진 돌연변이 특성을 역이용해 암세포를 선택적으로 제거하는 방법으로서 암 정밀의학(Cancer Precision Medicine)의 한 분야로 각광받고 있으며, 본 연구실에서는 이를 위해 CRISPR/Cas9을 이용한 유전자 Knockout, 저분자화합물, RNAi 와 microRNA 라이브러리를 이용한 스크리닝, RNA-sequencing과 세포신호전달 연구를 통한 Synthetic Lethality 메커니즘 분석, 그리고 동물실험과 임상 데이터베이스 분석을 통한 in vivo 항암효과 테스트 등 다양한 연구를 진행하고 있다.
[연구내용]
1. Synthetic Lethality
Synthetic Lethality는 번역하면 ‘합성치사’라고 할 수 있으며 이는 원래 초파리(Drosophila)와 Yeast 연구에서 유래된 유전자 간의 상호작용(Genetic Interaction) 중 하나이다. 예를 들어 두 개의 유전자가 Synthetic Lethality 상호작용을 할 때, 두 유전자가 모두 정상일 경우에 초파리는 건강하며, 둘 중 하나가 변이되어 기능을 상실하였을 경우에도 나머지 하나가 정상이므로 이 초파리 또한 건강하게 생존한다. 그러나 두 유전자가 모두 변이되어 기능을 상실할 경우 이 둘의 기능을 대체할 초파리 유전자가 없기 때문에 초파리는 죽게 된다. 이러한 경우 이 둘의 유전자는 Synthetic Lethality Interaction을 한다고 할 수 있다 (그림 1).
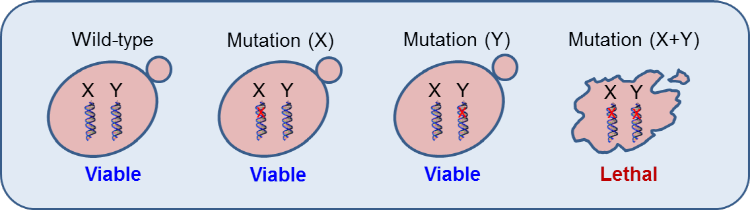
그림 1. Yeast에서의 Synthetic lethality 유전자 상호작용
2. 종양유전자(Oncogene)와 종양억제유전자(Tumor Suppressor)
암이 생성되고 발달하는 가장 큰 원인 중 하나가 유전자의 변이(Genetic Mutation)이며, 유전자의 변이가 종양유전자나 종양억제유전자에 생길 경우 암이 발생하게 된다. 이 경우 종양유전자의 변이는 활성화 변이(Activating Mutation 혹은 Gain-of-function Mutation)이며 이 유전자의 원래의 기능이 세포 성장을 촉진하는 것인데, 이것이 더욱 활성화되어 조절을 받지 못하는 상황이 되면 암을 유발하게 된다. 이러한 종양유전자의 변이로 인하여 생긴 암은 그 유전자가 생성하는 단백질의 기능을 약물로 억제함으로써 암세포를 죽이거나 성장을 멈추게 할 수 있기 때문에 약물 개발이 용이하다. 이와는 반대로 종양억제유전자에 변이가 일어나서 발생하는 암은 유전자의 기능을 상실하는 변이(Loss-of-function Mutation)로서 종양억제유전자의 원래 기능이 세포 성장을 조절하거나 억제하는 것인데 그 유전자가 코딩하는 단백질이 생성되지 못하거나 생성된 단백질이 제 기능을 수행하지 못하게 됨으로써 암이 발생하는 경우이다. 기능이 활성화되어서 문제가 되는 종양유전자와는 달리 종양억제유전자는 기능을 상실하여 문제가 되는 것이므로 이로 인해 생긴 암은 약물로써 치료하기가 매우 어렵다. 왜냐하면 약물은 대부분 저분자화합물이며 유전자의 변이로 인해 종양억제유전자 단백질이 생성되지 못하거나 생성된 단백질이 제 기능을 하지 못하는 현상을 저분자화합물을 이용하여 복구한다는 것은 거의 불가능에 가깝기 때문이다.
3. 종양억제유전자 변이와 Synthetic Lethality의 적용
Synthetic Lethality는 두 개(혹은 이상)의 상호작용하는 유전자가 동시에 기능을 상실하였을 경우에 세포가 사멸하는 현상인데, 종양억제유전자에 변이가 일어난 암세포의 경우는 이미 유전자 하나의 기능이 상실된 상태이므로 그 종양억제유전자와 Synthetic Lethality Interaction을 하는 또 하나의 유전자를 찾아서 그 기능을 억제하면 암세포는 죽게 된다. 정상세포는 종양억제유전자의 기능이 정상이므로 Synthetic Lethality Interaction하는 유전자의 기능을 억제하더라도 죽지 않는다. 이 방법을 이용하면 종양억제유전자가 변이된 암세포만 선택적으로 사멸시킬 수 있다 (그림 2). 이 경우 Synthetic Lethality Interaction하는 유전자의 기능 혹은 그 유전자가 생성하는 단백질의 기능을 약물로써 억제함으로써 암세포를 제거하는 것이 가능하다. Synthetic Lethality를 이용한 암치료법은 2000년대 초반에 종양억제유전자인 BRCA와 DNA Repair 효소인 PARP 간의 Synthetic Lethality Interaction이 처음으로 소개되면서 이 분야의 연구가 시작되었다 (Bryant, et al. (2005) Nature; Farmer, et al. (2005) Nature). 이 연구를 시발점으로 하여 여러 다른 종양억제유전자와 Synthetic Lethality Interaction을 스크리닝하는 연구가 진행되었으며 최근 세 개의 PARP 저해제 [Olaparib(Lynparza®), Rucaparib(Rubraca®), Niraparib(Zejula)]가 난소암 치료제로 FDA에 승인을 받으면서 Synthetic Lethality의 효용성이 임상에서 확인이 된 바 있다.
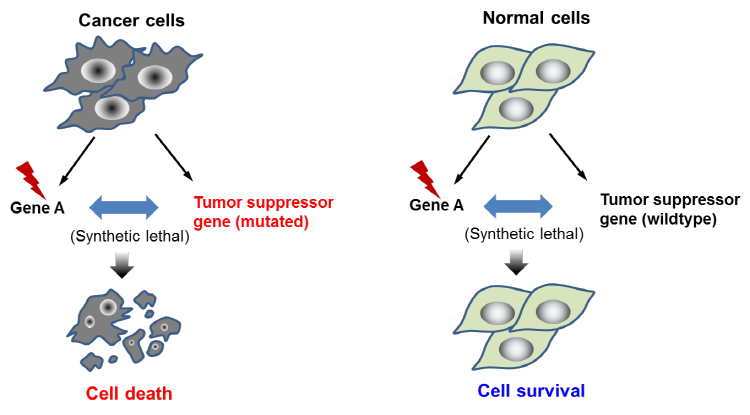
그림 2. Synthetic Lethality를 이용한 종양억제유전자 변이를 가진 암세포의 선택적인 제거.
유전자 A가 종양억제유전자와 Synthetic Lethality 상호작용을 할 때 유전자 A의 기능을 억제하면 종양억제유전자 변이를 가진 암세포는 죽지만 종양억제유전자가 정상인 정상세포는 죽지 않는다.
4. 본 연구실에서 진행 중인 연구
Synthetic Lethality를 이용한 항암치료 효과가 임상에서 증명되었으나 그동안의 항암 표적치료에서 나타난 여러 가지 문제점들 또한 나타나고 있다. 특히 Synthetic Lethality Interaction하는 유전자 한 가지를 억제함으로써 암세포의 사멸을 유도하는 과정에서 암세포가 그 유전자의 기능을 대체하는 또 다른 유전자를 활성화 함으로써 암세포의 약물내성(Drug Resistance)을 유발하게 된다. 또한 종양 내 이질성(Tumor Heterogeneity)으로 인해 Synthetic Lethality를 이용한 방식만으로는 암 조직을 완전히 억제하는 것에는 한계가 있다. 본 연구실에서는 현재 Major 종양억제유전자인 BRCA1, TP53, PTEN, RB, SMAD4를 비롯하여 비교적 최근에 알려진 ARID1A, CHD5등의 종양억제유전자들이 변이된 Isogenic Cancer Cell Line을 CRISPR/Cas9과 Lentiviral Overexpression을 통해 수립하였으며, 이를 이용해 저분자화합물, RNAi, microRNA 라이브러리에 스크리닝하여 각 종양억제유전자와 Synthetic Lethality 상호작용하는 유전자들을 발굴하고 있다. 최근의 연구성과로서 Epigenetics Machinery인 Bromodomain and Extra-Terminal Domain(BET)이 BRCA1과 Synthetic Lethality 상호작용하는 사실을 발견하였으며 이를 통해 BRCA1이 변이된 Triple Negative Breast Cancer(TNBC)에 BET 저해제가 매우 효과적임을 밝힌 바 있다 (1). 또한 SWI/SNF Nucleosome Remodeling Complex의 Component인 ARID1A가 세포분열과 G2/M Cell Cycle 조절에 중요한 역할을 하는 Aurora Kinase A(AURKA)와 Synthetic Lethality 상호작용을 하며, 이를 통해 종양억제유전자인 ARID1A가 변이된 대장암과 난소암에 AURKA 저해제가 매우 효과적으로 작용하는 것을 최근에 밝혀 현재 논문을 투고 중에 있다. 이러한 연구들 외에도 Synthetic Lethality-based Anticancer Therapy에 대한 암세포의 내성을 극복하기 위한 장기 프로젝트들을 수행하고 있으며 이 중 microRNA가 가진 Natural Intelligence를 이용하여 두 가지 이상의 Synthetic Lethality Interaction을 동시에 발견하여 그 약물들의 조합으로 암세포의 약제내성을 극복하고자 하는 연구를 현재 활발히 진행하고 있다.
[연구책임자]

심중섭 교수
주소: Faculty of Health Sciences, University of Macau E12-4010, Avenida da Universidade, Taipa, Macau SAR
전화: +853-8822-4990
Email: jsshim@umac.mo
Homepage: https://fhs.umac.mo/staff/academic-staff/joong-sup-shim/
[연구진구성]
교수: 심중섭
박사과정: Junfang Lyu, Changjie Wu, Yifan Liu, Baoyuan Zhang, Changxiang Shi
학부생: Wendy Che
연구원: Eun Ju Yang

[대표논문]
1. Zhang, B., Lyu, J., Liu, Y., Wu, C., Yang, E. J., Pardeshi, L., Tan, K., Wong, K. H., Chen, Q., Xu, X., Deng C. X., Shim, J. S. (2018) BRCA1 deficiency sensitizes breast cancer cells to bromodomain and extra-terminal domain (BET) inhibition. Oncogene (In Press).
2. Lyu, J., Yang, E. J., Head, S. A., Ai, N., Zhang, B., Wu, C., Li, R. J., Liu, Y., Yang, C., Dang, Y., Kwon, H. J., Ge, W., Liu, J. O., Shim, J. S. (2017) Pharmacological blockade of cholesterol trafficking by cepharanthine in endothelial cells suppresses angiogenesis and tumor growth. Cancer Lett 409, 91-103.
3. Shim, J. S., Li, R. J., Bumpus, N. N., Head, S. A., Kumar, K., Yang, E. J., Lv, J., Shi, W., Liu, J. O. (2016) Divergence of anti-angiogenic activity and hepatotoxicity of different stereoisomers of itraconazole. Clin Cancer Res 22, 2709-2720.
4. Shim, J. S., Li, R. J., Lv, J., Head, S. A., Yang, E. J., Liu, J. O. (2015) Inhibition of angiogenesis by selective estrogen receptor modulators through blockade of cholesterol trafficking rather than estrogen receptor antagonism. Cancer Lett 362, 106-115.
5. Shim, J. S., Rao, R., Beebe, K., Neckers, L., Han, I., Nahta, R., Liu, J. O. (2012) Selective inhibition of HER2-positive breast cancer cells by the HIV protease inhibitor nelfinavir. J Natl Cancer Inst 104, 1576-1590.
6. Shim, J. S., Matsui, Y., Bhat, S., Nacev, B. A., Xu, J., Bhang, H. E., Dhara, S., Han, K. C., Chong, C. R., Pomper, M. G., So, A., Liu, J. O. (2010) Effect of nitroxoline on angiogenesis and growth of human bladder cancer. J Natl Cancer Inst 102, 1855-1873.